துத்தநாக நைட்ரைடு
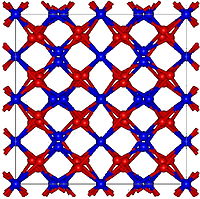
துத்தநாக நைட்ரைடு (Zinc nitride) என்பது Zn3N2 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். துத்தநாகம் மற்றும் நைட்ரசன் தனிமங்கள் சேர்ந்து இச்சேர்மம் உருவாகிறது. தூய்மையான நிலையில் இச்சேர்மம் கனசதுர அமைப்பில் காணப்படுகிறத[1][2]
| |
| இனங்காட்டிகள் | |
|---|---|
| 1313-49-1 | |
| பண்புகள் | |
| Zn3N2 | |
| வாய்ப்பாட்டு எடை | 224.15 கி/மோல்[1] |
| தோற்றம் | சாம்பல் நிறத் தூள்[1] |
| அடர்த்தி | 6.22 g/cm³, திண்மம்[1] |
| கரையாது (சிதைவடையும்) | |
| கட்டமைப்பு | |
| படிக அமைப்பு | கனசதுரம், cI80 |
| புறவெளித் தொகுதி | Ia-3, No. 206[1][2] |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | பட்டியலிடப்படவில்லை |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
வேதியியல் பண்புகள் தொகு
காற்றிலா சூழலில் துத்தநாகமைடு என்றழைக்கப்படும் துத்தநாக ஈரமீன், 200° செ வெப்பநிலையில் வெப்பச் சிதைவு மூலமாக துத்தநாக நைட்ரைடாக உருவாகிறது. [3] அமோனியா இவ்வினையில் உடன் விளை பொருளாக கிடைக்கிறது.[4]
துத்தநகத்தை 600° செ வெப்பநிலைக்கு அமோனியா பாய்வில் சூடுபடுத்தினாலும் இதைத் தயாரிக்கலாம்.ஐதரசன் வாயு உடன் விளைபொருளாக உண்டாகிறது.[3][5]
துத்தநாக நைட்ரைடு தண்ணீருடன் தீவிரமாக வினைபுரிந்து அமோனியா மற்றும் துத்தநாக ஆக்சைடாக உருவாகிறத[3][4]
துத்தநாக நைட்ரைடு, ஐதரோ குளோரிக் அமிலத்தில் [6]கரைகிறது. மின்வேதியியல் முறையில் மீள்வினையாக இலித்தியத்துடன் வினைபுரிகிறது.[7] மக்னீசியம் நைட்ரைடு (Mg3N2) மற்றும் இலித்தியம் நைட்ரைடு Li3N) போல இச்சேர்மமும் உயர் உருகுநிலை கொண்டுள்ளது[8].
மேற்கோள்கள் தொகு
- ↑ 1.0 1.1 1.2 1.3 1.4 Sangeeta, D. (1997). Inorganic Materials Chemistry Desk Reference. CRC Press. p. 278. பன்னாட்டுத் தரப்புத்தக எண் 978-0-8493-8900-9. பார்க்கப்பட்ட நாள் 2007-09-30.
- ↑ 2.0 2.1 Partin, D. E.; Williams, D. J.; O'Keeffe, M. (1997). "The Crystal Structures of Mg3N2 and Zn3N2". Journal of Solid State Chemistry 132 (1): 56–59. doi:10.1006/jssc.1997.7407. Bibcode: 1997JSSCh.132...56P. http://www.ingentaconnect.com/content/els/00224596/1997/00000132/00000001/art97407. பார்த்த நாள்: 2015-11-02.
- ↑ 3.0 3.1 3.2 Roscoe, H. E.; Schorlemmer, C. (1907) [1878]. A Treatise on Chemistry: Volume II, The Metals (4th ed.). London: Macmillan. pp. 650–651. பார்க்கப்பட்ட நாள் 2007-11-01.
- ↑ 4.0 4.1 Bloxam, C. L. (1903). Chemistry, Inorganic and Organic (9th ed.). Philadelphia: P. Blakiston's Son & Co. p. 380. பார்க்கப்பட்ட நாள் 2007-10-31.
- ↑ Lowry, M. T. (1922). Inorganic Chemistry. Macmillan. p. 872. பார்க்கப்பட்ட நாள் 2007-11-01.
- ↑
Comey, A. M.; Hahn, D. A. (1921). A Dictionary of Chemical Solubilities: Inorganic (2nd ed.). New York: Macmillan. p. 1124. பார்க்கப்பட்ட நாள் 2007-11-01.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Amatucci, G. G.; Pereira, N. (2004). "Nitride and Silicide Negative Electrodes". In Nazri, G.-A.; Pistoia, G. (ed.). Lithium Batteries: Science and Technology. Kluwer Academic Publishers. p. 256. பன்னாட்டுத் தரப்புத்தக எண் 978-1-4020-7628-2. பார்க்கப்பட்ட நாள் 2007-11-01.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Grolier Incorporated (1994). Academic American Encyclopedia. Danbury, CT: Grolier Inc. p. 202. பன்னாட்டுத் தரப்புத்தக எண் 978-0-7172-2053-3. பார்க்கப்பட்ட நாள் 2007-11-01.
உசாத்துணை தொகு
- Futsuhara, M.; Yoshioka, K.; Takai, O. (1998). "Structural, electrical and optical properties of zinc nitride thin films prepared by reactive RF magnetron sputtering". Thin Solid Films (எல்செவியர்) 322 (1): 274–281. doi:10.1016/S0040-6090(97)00910-3. Bibcode: 1998TSF...322..274F.
- Lyutaya, M. D.; Bakuta, S. A. (1980). "Synthesis of the nitrides of Group II elements". Powder Metallurgy and Metal Ceramics (Springer) 19 (2): 118–122. doi:10.1007/BF00792038.
புற இணைப்புகள் தொகு
- Material Safety Data Sheet from GFS Chemicals பரணிடப்பட்டது 2013-06-03 at the வந்தவழி இயந்திரம்