நிக்கல் டெட்ராகார்பனைல்
நிக்கல் கார்பனைல் (Nickel carbonyl) என்பது Ni(CO)4 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கரிமநிக்கல் சேர்மமாகும். ஐயுபிஏசி முறையில் இச்சேர்மத்தை டெட்ராகார்பனைல்நிக்கல் என்ற பெயரால் அழைக்கிறார்கள். நிக்கல்டெட்ராகார்பனைல் என்ற பெயராலும் இதை அழைக்கலாம். வெளிர் மஞ்சள் நிறத்தில் நீர்மமாகக் காணப்படும் இச்சேர்மம், நிக்கலின் இன்றியமையாத சேர்மங்களில் ஒன்றாகக் கருதப்படுகிறது. நிக்கலைத் தூய்மைப்படுத்தும் மோண்டு செயல்முறையில் ஓர் இடைநிலை விளைபொருளாக இது உருவாகிறது. கரிம உலோகவேதியியலில் ஒரு வினைப்பொருளாக இதைப் பயன்படுத்துகிறார்கள். கொடிய நச்சுத்தன்மை கொண்ட சேர்மமாக நிக்கல் கார்பனைல் கருதப்படுகிறது[3].
| |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
டெட்ராகார்பனைல்நிக்கல்
| |||
| வேறு பெயர்கள்
நிக்கல் டெட்ராகார்பனைல்
நிக்கல் கார்பனைல் | |||
| இனங்காட்டிகள் | |||
| 13463-39-3 | |||
| ChEBI | CHEBI:30372 | ||
| ChemSpider | 21865021 | ||
| EC number | 236-669-2 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 26039 | ||
| வே.ந.வி.ப எண் | QR6300000 | ||
SMILES
| |||
| UN number | 1259 | ||
| பண்புகள் | |||
| Ni(CO)4 | |||
| வாய்ப்பாட்டு எடை | 170.73 கி/மோல் | ||
| தோற்றம் | நிறமற்றது அல்லது வெளிர் மஞ்சள் நீர்மம்[1] டயாகாந்தப் பண்பு | ||
| மணம் | ஊசிய வாடை,[1] செங்கல் தூள் போல | ||
| அடர்த்தி | 1.319 கி/செ.மீ3 | ||
| உருகுநிலை | −17.2 °C (1.0 °F; 256.0 K) | ||
| கொதிநிலை | 43 °C (109 °F; 316 K) | ||
| 0.018 கி/100 மி.லி (10 °செல்சியசு) | |||
| கரைதிறன் | கரிமக் கரைப்பான்களுடன் கலக்கும் நைட்ரிக் அமிலம். இராச திராவகம் போன்ரவற்றில் கரையும் | ||
| ஆவியமுக்கம் | 315 மிமீபாதரசம் (20 °செல்சியசில்)[1] | ||
| பிசுக்குமை | 3.05 x 10−4 Pa s | ||
| கட்டமைப்பு | |||
| ஒருங்கிணைவு வடிவியல் |
நான்முகி | ||
| மூலக்கூறு வடிவம் | |||
| இருமுனைத் திருப்புமை (Dipole moment) | பூச்சியம் | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
−632 கிலோயூல்/மோல் | ||
| Std enthalpy of combustion ΔcH |
−1180 கிலோயூல்/மோல் | ||
| நியம மோலார் எந்திரோப்பி S |
320 யூல் கெல்வின்−1 மோல்−1 | ||
| தீங்குகள் | |||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0064 | ||
| ஈயூ வகைப்பாடு | தீப்பற்றும் (F) கொடிய நச்சு (T+) சுற்றுச் சூழலுக்கு அபாயம் (N) | ||
| R-சொற்றொடர்கள் | R61, R11, R26, R40, R50/53 | ||
| S-சொற்றொடர்கள் | S53, S45, S60, S61 | ||
| தீப்பற்றும் வெப்பநிலை | 4 °C (39 °F; 277 K) | ||
Autoignition
temperature |
60 °C (140 °F; 333 K) | ||
| வெடிபொருள் வரம்புகள் | 2–34% | ||
| Lethal dose or concentration (LD, LC): | |||
LC50 (Median concentration)
|
266 மில்லியனுக்குப் பகுதிகள் (பூனை, 30 நிமிடங்கள்) 35 மில்லியனுக்குப் பகுதிகள் (முயல், 30 நிமிடங்கள்) 94 மில்லியனுக்குப் பகுதிகள் (சுண்டெலி, 30 நிமிடங்கள்) 10 மில்லியனுக்குப் பகுதிகள் (சுண்டெலி, 10 நிமிடங்கள்)[2] | ||
LCLo (Lowest published)
|
360 மில்லியனுக்குப் பகுதிகள் (நாய், 90 நிமிடங்கள்) 30 மில்லியனுக்குப் பகுதிகள் (மனிதன், 30 நிமிடங்கள்) 42 மில்லியனுக்குப் பகுதிகள் (முயல், 30 நிமிடங்கள்) 7 மில்லியனுக்குப் பகுதிகள் (சுண்டெலி, 30 நிமிடங்கள்)[2] | ||
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |||
அனுமதிக்கத்தக்க வரம்பு
|
TWA 0.001 மில்லியனுக்குப் பகுதிகள் (0.007 மி.கி/மீ3)[1] | ||
பரிந்துரைக்கப்பட்ட வரம்பு
|
TWA 0.001 மில்லியனுக்குப் பகுதிகள் (0.007 மி.கி/மீ3)[1] | ||
உடனடி அபாயம்
|
Ca [2 மில்லியனுக்குப் பகுதிகள்][1] | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
| | |||
| Infobox references | |||
கட்டமைப்பும் பிணைப்பும் தொகு
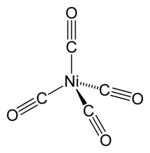
நிக்கல் டெட்ராகார்பனைலில் நிக்கலின் ஆக்சிசனேற்ற நிலை பூச்சியமாகும். நிக்கல் டெட்ராகார்பனைலின் வாய்ப்பாடு 18-எலக்ட்ரான் விதியை நிறைவு செய்து உறுதிப்படுகிறது. நிக்கல் அணுவுடன் நான்கு நான்கு கார்பனைல் ஈந்தனைவிகள் பிணைந்து நான்முகி வடிவத்தை இச்சேர்மம் வெளிப்படுத்துகிறது. கார்பனைல் ஈந்தனைவிகளில் கார்பன் மற்றும் ஆக்சிசன் அணுக்கள் முப்பிணைப்பால் கார்பன் முனைகள் வழியாக நிகலுடன் இணைந்துள்ளன. எலக்ட்ரான் விளிம்பு விளைவு ஆய்வுகளின் படி Ni–C பிணைப்பின் இடைவெளி 1.838(2) ஆங்சிட்ராம்கள் எனவும் C–O பிணைப்பின் இடைவெளி 1.141(2) ஆங்சிட்ராம்கள் எனவும் அறியப்படுகிறது [4].
தயாரிப்பு தொகு
Ni(CO)4 முதன்முதலில் 1890 ஆம் ஆண்டில் லுட்விக் மோண்டு என்பவரால் தொகுப்பு முறையில் தயாரிக்கப்பட்டது. நிக்கல் உலோகத்தின் மீது கார்பன் மோனாக்சைடு வயுவை நேரடியாகச் செலுத்தி வினைபுரியச் செய்து இவர் நிக்கல் டெட்ராகார்பனைல் சேர்மத்தைத் தயாரித்தார்[5]. இந்த முன்னோடித் தயாரிப்பு முறை V, Cr, Mn, Fe, மற்றும் Co. போன்ற தனிமங்களின் உலோகக் கார்பனைல் சேர்மங்கள் இருப்பதை முன்னிலைப்படுத்தியது. இம்முறை 19 ஆம் நூற்றாண்டின் இறுதியில் நிக்கல் சுத்திகரிப்புக்கு தொழில் ரீதியாக பயன்படுத்தப்பட்டது [6]. 323 கெல்வின் வெப்பநிலையில் கார்பன் மோனாக்சைடு வாயுவானது மாசுள்ள நிக்கல் மீது செலுத்தப்படுகிறது. 130 செல்சியசு வெப்பநிலை உகந்த வெப்பநிலையாகக் கருதப்படுகிறது [7].
Ni + 4CO --> Ni(CO)4
நிக்கல் சல்பைடுடன் கார்பன் மோனாக்சைடைச் செலுத்தியும் இதைத் தயாரிக்கிறார்கள்.
NiS+4CO --> Ni(CO)4 + S
வர்த்தகரீதியாக நிக்கல் டெட்ராகார்பனைல் கிடைப்பதில்லை. வர்த்தகரீதியாகக் கிடைக்கும் பிசு(வளைய ஆக்டாடையீன்)நிக்கல்(0) சேர்மத்தை கார்பனைலேற்றம் செய்து ஆய்வகத்தில் தயாரித்துக் கொள்கிறார்கள் [8].
வேதி வினைகள் தொகு
வெப்பத்தின் விளைவு தொகு
நிக்கல் டெட்ராகார்பனைலை மிதமான வெப்பநிலைக்கு சூடுபடுத்தும்போது அது நிக்கல் மற்றும் கார்பன் மோனாக்சைடாகச் சிதைவடைகிறது. நிக்கலைத் தூய்மைக்கும் மோண்டு செயல்முறைக்கு இவ்வினையே அடிப்படையாக அமைகிறது. 180 பாகை செல்சியசு வெப்பநிலைக்கு அருகில் இது வெப்பச் சிதைவு அடைகிறது. வெப்பநிலையின் உயர்வுக்கு ஏற்ப சிதைவு வேகமும் அதிகரிக்கிறது[7].
Ni (CO)4 Ni + 4CO
அணுக்கரு கவரிகள் மற்றும் ஒடுக்கும் முகவர்களுடன் வினை தொகு
மற்ற குறைந்த இணைதிறன் உலோகக் கார்பனைல்கள் போலவே நிக்கல் டெட்ராகார்பனைலும் அணுக்கரு கவரிகளால் தாக்கப்பட்டு பாதிக்கப்படுகிறது. நிக்கல் மையங்களில் அல்லது CO மையங்களில் இத்தாக்குதல் நிகழ்ந்து கார்பனைல் ஈந்தணைவிகள் இடப்பெயர்ச்சி செய்யப்படுகின்றன. இவ்வகையில் டிரைபீனைல்பாசுப்பீன் போன்ற வழங்கி ஈந்தணைவிகள் வினைபுரிந்து Ni(CO)3(PPh3) மற்றும் Ni(CO)2(PPh3)2 போன்ற சேர்மங்களைக் கொடுக்கின்றது. பைபிரிடின் மற்றும் தொடர்புடைய பிற ஈந்தனைவிகளும் இவ்வாறே செயலாற்றுகின்றன [9]. ஓர் ஈந்தணைவியின் எலக்ட்ரான் கொடையளிக்கும் திறன் அல்லது எலக்ட்ரான் எடுக்கும் திறனை அளவிடும் டோல்மேன் மின்னணு அளவுறுவை உறுதி செய்ய மற்ற ஈந்தணைவிகளுடன் சேர்த்து நிக்கல் டெட்ராகார்பனைல் பயன்படுத்தப்படுகிறது.
நிக்கல் கார்பனைலுடன் ஐதராக்சைடுகளைச் சேர்த்து சூடுபடுத்தினால் [Ni5(CO)12]2− மற்றும் [Ni6(CO)12]2− கொத்துகள் உருவாகின்றன. இவற்றை நிக்கல் கார்பனைலை ஒடுக்க வினைக்கு உட்படுத்தினாலும் பெற இயலும். இவ்வாறே நிக்கல் கார்பனைலை கார்பன் அணுக்கரு கவரிகளுடன் சேர்த்து வினைப்படுத்தினால் [Ni(CO)3C(O)Nu)]−. போன்ற அசைல் பெறுதிகள் உருவாகின்றன[10].
எலக்ட்ரான் கவரிகள் மற்றும் ஆக்சிசனேற்ற முகவர்களுடன் வினை தொகு
நிக்கல் கார்பனைலை ஆக்சிசனேற்றம் செய்யமுடியும். குளோரின் இதை ஆக்சிசனேற்றம் செய்து நிக்கல்(II) குளோரைடைக் கொடுக்கிறது. கார்பனோராக்சைடு வாயு வெளியேறுகிறது. மற்ற அலசன்களும் இதே முறையில் ஆக்சிசனேற்றம் செய்கின்றன.
Ni(CO)4 + Cl2 --> NiCl2 + CO
Ni(CO)4 + Br2 --> NiBr2 + CO
கொடிய நச்சான நிக்கல் டெட்ராகார்பனைலின் தேவையற்ற பகுதிகளை நீக்குதலுக்கு இம்முறை ஒரு பொருத்தமான முறையாகக் கருதப்படுகிறது.
Ni(CO)4 ஆல்க்கைல் மற்றும் அரைல் ஆலைடுகளுடன் வினைபுரிந்து கார்பனைலேற்ற கரிமப் பொருட்கள் உருவாகின்றன. PhCH=CHBr போன்ற வினைல் ஆலைடுகள் Ni(CO)4 சேர்மத்தையும் தொடர்ந்து சோடியம் மெத்தாக்சைடு சேர்த்து சூடுபடுத்தினால் நிறைவுறாத எசுத்தர்களாக மாற்றப்படுகின்றன. இது போன்ற வினைகள் ஆக்சிசனேற்ற கூட்டு வினை வழியாகவும் நிகழ்கின்றன. அல்லைலிக் ஆலைடுகள் (அல்லைல்)2Ni2Cl2 போன்ற π-அல்லைல்நிக்கல் சேர்மங்களைக் கொடுக்கின்றன :[11]
2 Ni(CO)4 + 2 ClCH2CH=CH2 → Ni2(μ-Cl)2(η3-C3H5)2 + 8 CO.
ஆபத்தும் பாதுகாப்பும் தொகு
Ni(CO)4 சேர்மத்தின் ஆபத்துகள் அதன் உள்ளடக்கப் பொருளான CO வாயு ஆபத்துகளை விட அதிகமாகும். நிக்கல் உடலுக்குள் வெளிப்பட்டால் ஏற்படும் விளைவுகளை இது பிரதிபலிக்கிறது. நிக்கல் கார்பனைல் அதிக அளவில் ஆவியாவதால் தோல் அல்லது உறிஞ்சுதல் மூலம் உள்ளிழுக்கப்பட்டு கடுமையான பாதிப்புகளை உண்டாக்குகிறது. உயிர்கொல்லும் செறிவு LC50 அளவுடன் 30 நிமிடங்கள் வெளிப்பட்டால் இதன் பாதிப்பி மில்லியனுக்கு 3 பகுதிகள் என மதிப்பிடப்பட்டுள்ளது. இதே அடர்த்தியுல் இச்சேர்மம் மனித உடலுக்குள் வெளிப்பட்டால் அதன் பாதிப்பு அளவு மில்லியனுக்கு 30 பகுதிகளாகும். மில்லியனுக்கு 5 பகுதிகள் வரை சில உயிரினங்கள் ஊசிய நெடியால் மூச்சு அல்லது அடர்புகை உள்ளிழுக்கப்பட்டு பாதிக்கப்படுகின்றன[12].
நிக்கல் கார்பனைலின் ஆவி தானாக தீப்பற்றி எரியும் தன்மை கொண்டதாகும். காற்ரில் இது வேகமாகச் சிதைவடைகிறது. இதன் அரை வாழுவுக்காலம் 40 வினாடிகள் ஆகும்[13]. நிக்கல் கார்பனைல் நச்சு பாதிக்கப்பட்டால் இரண்டு நிலைகளில் நோய் பாதிப்பு ஏற்படுகிறது. முதலாவதாக தலைவலியும் நெஞ்சு வலியும் சில மணி நேரங்களுக்கு நீடிக்கும். பின்னர் குறுகிய நேரத்திற்கு குணமடைந்தது போலத் தோன்றும். 16 மணி நேரத்திற்குப் பின்னர் இரண்டாம் நிலையில் வேதியியல் சார்பு நுரையீரல் அழற்சி இருமல் மற்றும் சுவாசக் கோளாறு போன்ற அடையாளங்களுடன் கடுமையான பாதிப்புகள் தோன்றும். நான்கு நாட்கள் இதேநிலையில் தொடர்ந்து சிறுநீரக செயலிழப்பு அல்லது இதயப்பாதிப்பு போன்றவை ஏற்பட்டு உயிரிழப்பு வரை ஏற்படுத்தும்.
அமெரிக்காவில் இச்சேர்மத்தை ஒரு கடுமையான வேதிப்பொருளாக கருதுமளவிற்கு சட்டம் இயற்றப்பட்டுள்ளது [14].
மேற்கோள்கள் தொகு
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 "NIOSH Pocket Guide to Chemical Hazards #0444". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 2.0 2.1 "Nickel carbonyl". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ The Merck Index (7th ). Merck.
- ↑ Hedberg, L.; Iijima, T.; Hedberg, K. (1979). "Nickel tetracarbonyl, Ni(CO)4. I. Molecular Structure by Gaseous Electron Diffraction. II. Refinement of Quadratic Force Field". The Journal of Chemical Physics 70 (7): 3224–3229. doi:10.1063/1.437911.
- ↑ Ludwig Mond; Langer, C.; Quincke, F. (1890). "Action of Carbon Monoxide on Nickel". J. Chem. Soc. Trans. 57: 749–753. doi:10.1039/CT8905700749. https://archive.org/details/sim_journal-of-the-chemical-society-transactions_1890_57/page/749.
- ↑ "The Extraction of Nickel from its Ores by the Mond Process". Nature 59 (1516): 63–64. 1898. doi:10.1038/059063a0.
- ↑ 7.0 7.1 Lascelles, K.; Morgan, L. G.; Nicholls, D.; Beyersmann, D. (2005), "Nickel Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a17_235.pub2
{{citation}}: CS1 maint: multiple names: authors list (link) - ↑ Jolly, P. W. (1982). "Nickel Tetracarbonyl". Comprehensive Organometallic Chemistry I. Oxford: Pergamon Press.
- ↑ Elschenbroich, C.; Salzer, A. (1992). Organometallics: A Concise Introduction (2nd ). Weinheim: Wiley-VCH. பன்னாட்டுத் தரப்புத்தக எண்:3-527-28165-7.
- ↑ Pinhas, A. R. (2003). "Tetracarbonylnickel". Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. DOI:10.1002/047084289X.rt025m. ISBN 0471936235.
- ↑ Semmelhack, M. F.; Helquist, P. M. (1972). "Reaction of Aryl Halides with π-Allylnickel Halides: Methallylbenzene". Organic Syntheses 52: 115. http://www.orgsyn.org/demo.aspx?prep=cv6p0722.; Collective Volume, vol. 6, p. 722
- ↑ Board on Environmental Studies and Toxicology (2008). "Nickel Carbonyl: Acute Exposure Guideline Levels". Acute Exposure Guideline Levels for Selected Airborne Chemicals. 6. National Academies Press. பக். 213–259. http://books.nap.edu/openbook.php?record_id=12018&page=159.
- ↑ Stedman, D. H.; Hikade, D. A.; Pearson, R., Jr.; Yalvac, E. D. (1980). "Nickel Carbonyl: Decomposition in Air and Related Kinetic Studies". Science 208 (4447): 1029–1031. doi:10.1126/science.208.4447.1029. பப்மெட்:17779026.
- ↑ 40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities (July 1, 2008 ). Government Printing Office. http://edocket.access.gpo.gov/cfr_2008/julqtr/pdf/40cfr355AppA.pdf. பார்த்த நாள்: October 29, 2011.

