கனசதுர அணு
கனசதுர அணு (cubical atom) என்பது ஒரு மிகப்பழைய அணு மாதிரியாகும். இம்மாதிரியில் மின்முனைவற்ற அணு அல்லது மூலக்கூறின் எலக்ட்ரான்கள் கனசதுரத்தின் எட்டு மூலைகளிலும் நிலைபெறுகின்றன. கில்பெர்ட்டு நியூட்டன் இலூயிசு 1902 ஆம் ஆண்டு இக்கருதுகோளை முன்மொழிந்து 1916 ஆம் ஆண்டு அணு மற்றும் மூலக்கூறு என்ற தன்னுடைய கட்டுரையில் வெளியிட்டார். இணைதிறன் என்ற நிகழ்வை விவரிப்பதற்காக இதை அவர் பயன்படுத்தினார்[1]. இலூயிசு கோட்பாடு, அபெக்கு விதியை அடிப்படையாகக் கொண்டது ஆகும். இர்விங் லேங்மியூர் 1919 ஆம் ஆண்டு இவ்விதியை கனசதுர எண்ம அணு என்று மேலும் விரிவாக்கினார்[2]. கீழ்கண்ட படம் தனிமவரிசை அட்டவனையின் இரண்டாவது வரிசைத் தனிமங்களின் கட்டமைப்பு உருவ அமைப்பை அளிக்கிறது.
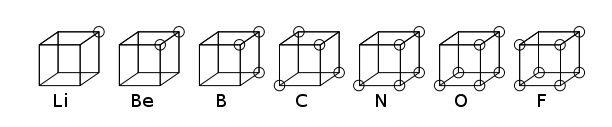
என்றாலும் கனசதுர அணு மாதிரி கோட்பாடானது, சுரோடிங்கர் சமன்பாடு அடிப்படையில் உருவான குவாண்டம் இயங்கியல் கோட்பாடு மாதிரிக்கு ஆதரவாக விரைவில் கைவிடப்பட்டது. வேதிப் பிணைப்புகள் தொடர்பான செய்திகளைச் சரியாகப் புரிந்துகொள்வதற்கான முக்கியமான படிநிலையாகவும், கொள்கை ரீதியாகவும் இது வரலாற்று முக்கியத்துவம் பெறுகிறது. 1916 ஆம் ஆண்டு வெளியிடப்பட்ட கட்டுரையிலும் இலூயிசு சகப் பிணைப்பிலுள்ள எலக்ட்ரான் இணைகளை, தற்போது இலூயிசு கட்டமைப்பு எனப்படும் எண்ம விதியை,அறிமுகப்படுத்தியுள்ளார்.
கனசதுர அணு மாதிரியும் பிணைப்பும்
தொகுபடம் சி யில் உள்ளது போல இரண்டு அணுக்கள் ஒரு விளிம்பைப் பகிர்ந்துக் கொண்டு ஒற்றைச் சகபிணைப்பு உருவாகிறது. இதன் விளைவாக இரண்டு எலக்ட்ரான்கள் பகிர்ந்து கொள்ளப்படுகின்றன. ஒரு கனசதுரத்திலிருந்து மற்றொரு கனசதுரத்திற்கு எலக்ட்ரான்களை மாற்றுவதால் அயனிப்பிணைப்பு உருவாகிறது. விளிம்பு பகிரப்படாமல் படம் ஏ வில் உள்ளது போல பிணைப்பு உருவாகிறது. இவ்விரு நிலையும் இல்லாமல் படம் பி யில் உள்ளது போல ஒரு இடைநிலைக் கட்டமைப்பு, அதாவது ஒரேயொரு மூலை மட்டும் பகிர்ந்து கொள்ளப்பட்டு பிணைப்பு உருவாகிறது என்பதையும் இலூயிசே முன்மொழிந்தார்.
கனசதுரத்தின் ஒரு முகம் பகிர்ந்து கொள்ளப்படுவதால் இரட்டைப் பிணைப்புகள் உருவாகின்றன. இங்கு நான்கு எலக்ட்ரான்கள் பகிர்ந்து கொள்ளப்படுகின்றன.
முப்பிணைப்புகளைக் இரண்டு கனசதுரங்கள், மூன்று இணை விளிம்புகளை பகிர்ந்து கொள்வதற்கு வழி இல்லை என்பதால் கனசதுர அணு அமைப்பில் முப்பிணைப்பு உருவாதலுக்கான வாய்ப்பு இல்லை. அணு பிணைப்புகளில் உள்ள எலக்ட்ரான் இணைகள் ஒரு வகையான சிறப்பு ஈர்ப்பைக் கொண்டுள்ளன என்று இலூயிசு கருத்துரைக்கிறார். எனவே,கீழே படத்தில் உள்ளவாறு ஒரு நான்முக அமைப்பிலான வடிவமைப்பு ஏற்படுகிறது என்று கூறுகிறார். (எலக்ட்ரான்களுக்கான புதிய இடம், கனமான விளிம்புகளின் மையத்தில் புள்ளியிட்ட வட்டங்களாக காட்டப்பட்டுள்ளது.) மூலைகள் பகிர்ந்து ஒற்றைப் பிணைப்பு உருவாதலையும், விளிம்புகள் பகிர்ந்து இரட்டைப் பிணைப்புகள் உருவாதலையும் மற்றும் முகம் பகிர்ந்து முப்பிணைப்பு உருவாதலையும் இது அனுமதிக்கிறது. மேலும், ஒற்றைப் பிணைப்பைச் சுற்றி சுதந்திரமாக சுழல்வதையும் மீத்தேனில் நான்முக வடிவமைப்பையும் இது அனுமதிக்கிறது.
மேற்கோள்கள்
தொகு- ↑ Lewis, Gilbert N. (1916-04-01). "The Atom and the Molecule.". Journal of the American Chemical Society 38 (4): 762–785. doi:10.1021/ja02261a002. http://osulibrary.oregonstate.edu/specialcollections/coll/pauling/bond/papers/corr216.3-lewispub-19160400.html. See images of original article http://chimie.scola.ac-paris.fr/sitedechimie/hist_chi/text_origin/lewis/Lewis-1916.htm
- ↑ Langmuir, Irving (1919-06-01). "The Arrangement of Electrons in Atoms and Molecules.". Journal of the American Chemical Society 41 (6): 868–934. doi:10.1021/ja02227a002.