சயனேற்றம்
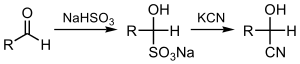
சயனேற்றம் (cyanation) என்பது வெவ்வேறு தள மூலக்கூறுகளுடன் சயனைடு தொகுதியை இணைப்பது அல்லது பதிலீடு செய்வதாகும். பென்சைலிக் ஆல்ககால்களை நேரடியாக சயனேற்றம் செய்யும் போது குறைவான நேரத்தில் தொடர்புடைய அதிக அளவு நைட்ரைல் சேர்மங்கள் உருவாகின்றன.
அரீன்களின் சயனேற்றம்
தொகுஇரண்டு எலக்ட்ரான் மின்னணு கவரியாக அரீனுடன்
தொகுபாரம்பரிய ரோசென்மண்டு வோன்-பிரான் வினையில் தாமிர(I) சயனைடு விகிதவியல் அளவில் சயனேற்ற மூலமாக பயன்படுத்திக் கொள்ளப்படுகிறது. தாமிரத்தின் வினைவேக மாற்றிகளாக பல்வேறு புதிய வகைச் சேர்மங்கள் தோன்றுகின்றன. :[1]
கூடுதலாக அரைல் ஆலைடுகளின் பலேடியம் வினையூக்க சயனேற்ற வினைகள் பரவலாக ஆராயப்பட்டன. பொதுவாக KCN அல்லது அதன் துணை நச்சான Zn(CN)2 போன்றவை உட்கருகவர் சயனைடு மூலங்களாக பயன்படுத்தப்பட்டன. நச்சுத் தன்மையின் அளவை மேலும் குறைக்க, பொட்டாசியம் பெரிசயனைடும் ஒரு சயனைடு மூலமாக பயன்படுத்தப்படுகிறது. வினையூக்கச் சுழற்சிகள் நிலையான பலேடியம் பாதை வழியாக செல்லக்கூடியதாக இருக்கும் என நம்பப்படுகிறது. அதிக சயனைடு சேர்த்து Pd(II) அயனியை செயலிழக்கச் செய்வது பொதுவான பிரச்சினையாகும் [2]. அரைல் அயோடைடுகள், புரோமைடுகள், குளோரைடுகள் போன்றவற்றுக்கும் பலேடியம் வினையூக்கி நிபந்தனைகள் மேம்படுத்தப்பட்டுள்ளன [3]
.
நிக்கல்-வினையூக்க சயனேற்ற வினைகல் விலைமதிப்பான உலோகங்களின் உபயோகத்தை தவிர்க்கின்றன. கார்பன் – கார்பன் பிணைப்பை பிளந்து குறைப்பதன் வழியாக பென்சைல் சயனைடு அல்லது அசிட்டோ நைட்ரைல் ஆகியவற்றை சயனைடு மூலமாக பயன்படுத்த சாத்தியமாகிறது :[4]
.
இடைநிலைத் தனிமங்களை வினையூக்கியாகஒப் பயன்படுத்தி அல்லது பயன்படுத்தாமல் அனிலீன் வழிப்பெறுதிகளை நேரடியாக சயனேற்றம் செய்வதை சேண்டுமேயர் சயனேற்ற வினை அளிக்கிறது. இடைநிலைத் தனிமங்களைப் பயன்படுத்தினால் சயனேற்றம் இரண்டு எலக்ட்ரான் சயனேற்றம் என ஒப்புக்கொள்ளப்படுகிறது. அதேவேளையில் உலோகங்கள் இல்லாத தனியுறுப்பு வினை கடத்திகளில் இவ்வினையானது அநேகமாக தனியுறுப்பு வினையாக இருக்கும் :[5]
அரீன் இரண்டு –எலக்ட்ரான் உட்கருகவரியாக
தொகுஉலோகமேற்ற அரீன்களை சயனமைடுகள், சயனேட்டுகள், டைமெத்தில்மேலனோநைட்ரைல்கள் அல்லது எத்தில்(ஈத்தாக்சிமெத்திலீன்)சயனோ அசிட்டேட்டு போன்ற மின்னணுகவரி சயனைடு மூலங்களைப் பயன்படுத்தி சயனேற்றம் செய்யலாம். இவ்வினைக்கு இடைநிலைத் தனிம இடைமுகத்தைப் பயன்படுத்தியோ பயன்படுத்தாமலோ நிகழ்த்தலாம்:[6]
அரீன் ஒரு தனியுறுப்பு மின்னணுகவரியாக
தொகுஅரீன்கள் தனியுறுப்பு போல C-H சயனேற்ற வினைகளும் அறியப்படுகின்றன. உலோக அல்லது கரிம ஒளியொடுக்க இடைமுகங்கள் இவ்வினையில் பொதுவானவையாகும் :[7]
.
மேற்கோள்கள்
தொகு- ↑ Wu, Jeff (2002). "Catalytic Rosenmund–von Braun reaction in halide-based ionic liquids". Tetrahedron Letters 43: 387. https://archive.org/details/sim_tetrahedron-letters_2002-01-14_43_3_0/page/n61.
- ↑ Cohen, Daniel (2015). "Mild Palladium-Catalyzed Cyanation of (Hetero)aryl Halides and Triflates in Aqueous Media". Organic Letters 17: 202.
- ↑ Jin, Fuqiang (2000). "Palladium-catalyzed cyanation reactions of aryl chlorides". Tetrahedron Letters 41: 3271. https://archive.org/details/sim_tetrahedron-letters_2000-04-22_41_17/page/n289.
- ↑ Ueda, Yohei (2019). "Nickel-catalyzed cyanation of aryl halides and triflates using acetonitrile via C–CN bond cleavage assisted by 1,4-bis(trimethylsilyl)-2,3,5,6-tetramethyl-1,4-dihydropyrazine". Chemical Science 10: 994.
- ↑ Barbero, Margherita (2016). "Copper-free Sandmeyer cyanation of arenediazonium o-benzenedisulfonimides". Organic & Biomolecular Chemistry 14: 1437.
- ↑ Reeves, Jonathan (2015). "Transnitrilation from Dimethylmalononitrile to Aryl Grignard and Lithium Reagents: A Practical Method for Aryl Nitrile Synthesis". Journal of the American Chemical Society 137: 9481.
- ↑ McManus, Joshua (2017). "Direct C–H Cyanation of Arenes via Organic Photoredox Catalysis". Journal of the American Chemical Society 139: 2880.