மூலக்கூறு
மூலக்கூறு (Molecule) என்பது இரண்டு அல்லது அதற்கு மேற்பட்ட அணுக்கள் வேதிப் பிணைப்புகளால் ஒன்றாகப் பிணைக்கப்பட்டு மின்சுமை ஏதுமின்றி நடுநிலையுடன் காணப்படும் ஒரு தொகுதியாகும்[4][5][6][7][8]. மூலக்கூறுகள் மின்சுமையற்றவை என்பது மட்டுமே அயனிக்கும் மூலக்கூறுக்கும் உள்ள ஒரே வேறுபாடு ஆகும். இருப்பினும் குவாண்டம் இயற்பியல், கரிம வேதியியல், மற்றும் உயிர் வேதியியல் துறைகளில் மூலக்கூறு என்ற சொல் பெரும்பாலும் பல்லணு அயனி என்ற பொருளிலேயே பயன்படுத்தப்படுகிறது.
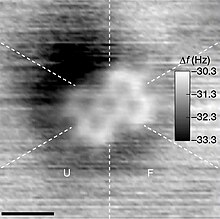


உட்கூறுகளைப் பற்றி சிறிதும் பொருட்படுத்தாமல், மூலக்கூறு என்பது வாயுநிலையில் உள்ள துகள் என்ற அர்த்தத்துடன் வாயுக்களின் இயக்கவியற் கொள்கை மூலக்கூறு என்ற சொல்லைப் பயன்படுத்துகிறது. மந்த வாயுக்களின் அணுக்கள் உண்மையில் ஓரணு மூலக்கூறுகளாயிருந்தாலும் வாயுக்களின் இயக்கவியற் கொள்கையின்படி அவை மூலக்கூறுகளாகக் கருதப்படுகின்றன [9]. ஒரு மூலக்கூறு என்பது ஓரினவுட்கருவாக இருக்கலாம். அதாவது ஆக்சிசன் மூலக்கூறில் (O2) இருப்பது போல ஒரேயொரு வேதித்தனிமத்தின் அணுக்களைக் கொண்ட தொகுதியாக ஒரு மூலக்கூறு இருக்கலாம். அல்லது ஒரு மூலக்கூறு என்பது பல்லினவுட்கருவாக இருக்கலாம். அதாவது நீர் மூலக்கூறில் (H2O) உள்ளதுபோல ஒன்றுக்கு மேற்பட்ட தனிமங்களின் அணுக்களைக் கொண்ட தொகுதியாக இருக்கலாம். சகப்பிணைப்பால் பிணைக்கப்படாமல் ஐதரசன் பிணைப்பு அல்லது அயனிப் பிணைப்பால் பிணைக்கப்பட்டுள்ள அணுக்களும் அணைவுத் தொகுப்புகளும் பொதுவாக ஒற்றை மூலக்கூறுகளாக கருதப்படுவதில்லை [10].
பருப்பொருளின் அங்கங்களாக உள்ள மூலக்கூறுகள் என்பவை கரிமப்பொருள்களில் பொதுவாகக் காணப்படுகின்றன. இந்த காரணத்தாலேயே உயிர் வேதியியல் என்ற துறையும் தோன்றியது. பருப்பொருளின் அங்கங்களாலேயே பெரும்பாலான பெருங்கடல்களும் வளிமண்டலமும் தோன்றியுள்ளன. எனினும், பூமியின் மேலோடு, அதையடுத்த மூடகம் அல்லது காப்புறை, புவியின் மையப்பகுதி முதலானவற்றை உருவாக்கிய, பூமியின் மேல் பெரும்பான்மையாகக் காணப்படும் நன்கு அறியப்பட்ட திடப்பொருட்களாக உள்ள கனிமங்கள் பல வேதிப்பிணைப்புகளைக் கொண்டுள்ளன. ஆனால் அவை அடையாளம் கண்டுகொள்ளத்தக்க மூலக்கூறுகளால் உருவாக்கப்படவில்லை. பெரும்பாலும் அலகு செல் மீண்டும் மீண்டும் திரும்பிவந்து கிராபீனில் உள்ளது போல சமதளத்தில் நீட்சி பெற்று அல்லது வைரம், குவார்ட்சு, அல்லது சோடியம் குளோரைடில் உள்ளது போல முப்பரிமானத்தில் நீட்சி பெற்று இருந்தபோதிலும், அயனிப் படிகங்களுக்காகவும் (உப்புகள்), சகப்பிணைப்பு படிகங்களுக்காகவும் (வலை அமைப்பு திண்மங்கள்) குறிப்பிட்டதொரு மூலக்கூறு எதுவும் வரையறுக்கப்படவில்லை. மீளும் அலகுசெல் கட்டமைப்பின் கருப்பொருள் உலோகப்பிணைப்பின் பல சுருங்கமைப்பு நிலைகளுக்குப் பொருந்துகிறது. திட உலோகங்களும் மூலக்கூறுகளால் உருவாக்கப்படவில்லை என்பது இதன் பொருளாகும். கண்ணாடிகளிலும் அணுக்கள் வேதிப்பிணைப்புகளால் இணைக்கப்பட்டு ஒன்றாக இருந்தாலும் இங்கும் அடையாளம் காணக்கூடிய மூலக்கூறுகள் எதுவுமில்லை, அல்லது படிகங்களை அடையாளப்படுத்தும் மீளும் அலகு செல் ஒழுங்குமுறையும் இல்லை.
மூலக்கூற்று அறிவியல்
தொகுமூலக்கூறுகளைப் பற்றிய அறிவியல் பிரிவு மூலக்கூற்று வேதியியல் அல்லது மூலக்கூற்று இயற்பியல் என்று அழைக்கப்படுகிறது. மூலக்கூறுகள் வேதியியலை மையமாகக் கொண்டு இருந்தால் அப்பிரிவு மூலக்கூற்று வேதியியல் எனவும் அவை இயற்பியலை மையமாகக் கொண்டு இருந்தால் அப்பிரிவு மூலக்கூற்று இயற்பியல் என்றும் கருதப்படுகிறது. வேதிப் பிணைப்புகள் உருவாக்கத்திலும் சிதைவிலும் தொடர்புடைய மூலக்கூறிடை வினைகளின் விதிகளை மூலக்கூற்று வேதியியல் ஆராய்கிறது. மூலக்கூறுகளின் கட்டமைப்பு, பண்புகள் தொடர்பான விதிகளை ஆராய்வது மூலக்கூறு இயற்பியலாகும். எனினும், நடைமுறையில், இவ்வேறுபாடுகள் தெளிவற்றனவாக உள்ளன. இரண்டு அல்லது அதற்கு மேற்பட்ட அணுக்கள் சேர்ந்த தொகுதியே மூலக்கூறு என்று மூலக்கூற்று அறிவியல் திட்டவட்டமான நிலையான எல்லையை குறிப்பிடுகிறது. பல்லணு அயனிகள் சில சமயங்களில் மின்சுமையேற்ற மூலக்கூறுகளை விவரிக்க பயனுள்ளதாக உள்ளது. அதிக வினைத்திறன் கொண்ட மூலக்கூறுகளை விவரிக்க நிலைப்புத்தன்மையற்ற மூலக்கூறுகள் என்ற சொல் பயன்படுத்தப்படுகிறது. ஒத்திசைவு எலக்ட்ரான்கள், உட்கருக்கள், இயங்குறுப்புகள், மூலக்கூற்று அயனிகள், இரிட்பெர்க்கு மூலக்கூறுகள், இடைநிலைகள், வாண்டர்வால்சு அணைவுச் சேர்மங்கள், போசு-ஐன்சுடீன் செறிபொருளில் மோதும் அணுக்கள் போன்றவை அதிக செயல்திறன் மிக்க மூலக்கூறுகளாகக் கருதப்படுகின்றன.
வரலாறும் பெயர்க்காரணமும்
தொகுமெரியம் வெப்சுடர் மற்றும் நிகழ்நேர சொற்பிறப்பியல் அகராதியின்படி "மூலக்கூறு" என்ற சொல் இலத்தீன் மொழி சொல்லான மோல்சு அல்லது நிறையின் சிறிய அலகு என்பதிலிருந்து பெறப்பட்டது ஆகும்.
மூலக்கூறு (1794) – "மிகவும் நுண்ணிய துகள்" என்ற பொருள் கொண்ட மாலிகியூல் என்ற பிரெஞ்சு மொழி சொல்லிலிருந்தும் (1678), புதிய இலத்தீன் மொழிச் சொல்லான மாலிகியூலா என்ற சொல்லிலிருந்தும், மிகவும் சிறிய என்ற பொருள் கொண்ட மோல்சு என்ற இலத்தீன் சொல்லில் இருந்தும் பெறப்பட்டது. முதலில் தெளிவற்ற பொருள் கொண்டிருந்த 18 ஆம் நூற்றாண்டின் பிற்பகுதிவரை இலத்தீன் வடிவத்திலேயே பயன்படுத்தப்பட்ட இச்சொல், இரெனே டேக்கார்டின் தத்துவத்தினால் இனங்காணப்பட்டது [11][12].
மூலக்கூறு பற்றிய அறிவு வளரவளர மூலக்கூறு தொடர்பான வரையறைகளும் விரிவடைந்தன. தொடக்கக் கால வரையறைகளில் துல்லியம் குறைவாக இருந்தது. மூலக்கூறுகள் என்பவை தூய வேதிப்பொருட்களின் வேதிப்பண்புகளும் உட்கூறுகளும் கொண்ட மிகச்சிறிய துகள்கள் என்று அவை வரையறுத்தன [13].சாதாரணமாகக் காணப்படும் பாறைகள், உப்புகள், உலோகங்கள் போன்றவை வேதியியல் முறையில் பிணைக்கப்பட்ட அணுக்கள் அல்லது அயனிகளின் பெரிய படிக வலையமைப்புகளால் உருவாக்கப்பட்டவையாகும் ஆனால் இவை வெவ்வேறான மூலக்கூறுகளால் உருவாக்கப்படவில்லை என்பதால் மேற்கண்ட வரையறை முக்கியத்துவம் பெறவில்லை.
பிணைப்பு
தொகுசகப்பிணைப்பு அல்லது அயனிப் பிணைப்பால் மூலக்கூறுகள் பிணைக்கப்பட்டு ஒன்றாக உள்ளன. பலவகையான அலோகங்கள் வளிமண்டலத்தில் மூலக்கூறுகளாக உள்ளன. உதாரணமாக ஐதரசன், ஐதரசன் மூலக்கூறாகவே உள்ளது. ஒரு சேர்மத்தின் மூலக்கூறு என்பது இரண்டு அல்லது அதற்கு மேற்பட்ட தனிமங்களைக் கொண்டது ஆகும்[14].
சகப்பிணைப்பு
தொகுஒரு சகப் பிணைப்பு என்பது பிணைப்பில் ஈடுபடும் அணுக்களுக்கு இடையில் எலக்ட்ரான் இணைகள் பங்கீடு அடைவதால் உருவாகும் பிணைப்புவகையாகும். இந்த எலக்ட்ரான் இணைகள் பகிர்வு இணைகள் அல்லது பிணைப்பு இணைகள் எனப்படுகின்றன. எலக்ட்ரான் இணைகளை தங்களுக்குள் பங்கிட்டுக் கொண்டு அணுக்களுக்கிடையில் நிலவும் கவர்ச்சி விசையையும் விலக்கு விசையையும் நிலையாக வைத்திருக்கும் பிணைப்பு சகப்பிணைப்பு எனப்படுகிறது [15]. பங்கீட்டு வலுப்பிணைப்பு, பகிர்பிணைப்பு என்ற பெயர்களாலும் இப்பிணைப்பு அறியப்படுகிறது.
சகப்பிணைப்பின்போது அணுக்கள் நிலையான எட்டு எலக்ட்ரான் அமைப்பைப் பெறுகின்றன. இச்செயல்முறையின்போது அணுக்களில் உள்ள அணு ஆர்பிட்டால்கள் மேற்பொருந்துவதால் எலக்ட்ரான்கள் தங்களுக்குள் பங்கீடு செய்து கொள்கின்றன. அணு ஆர்பிட்டால்கள் மேற்பொருந்துவதால் உருவாகும் அணுக்களுக்கிடைப்பட்ட பிணைப்பே சகப்பிணைப்பு என்றும் இப்பிணைப்பை வரையறுக்கலாம். பொதுவாக அணுக்களின் இணைதிறன் கூட்டிலுள்ள ஆர்பிட்டால்களின் எலக்ட்ரான்கள், எலக்ட்ரான் பங்கீட்டில் பயன்படுத்தப்படுகிறது. பங்கிடப்பட்ட எலக்ட்ரான்கள் சகப்பிணைப்பின் மத்தியில் அமையும். மேலும், சகப்பிணைப்பில் பங்கிடப்பட்ட எலக்ட்ரான் இணையையும் சேர்த்து ஒவ்வோர் அணுவும் எட்டு எலக்ட்ரான் அமைப்பைப் பெற்றிருக்கும். ஐதரசன் அணுக்களில் உள்ள இரண்டு s-ஆர்பிட்டால்களின் எலக்ட்ரான்கள் மேற்பொருந்துவதால் சகப்பிணைப்பு உருவாகிறது. ஒவ்வொரு H அணுவும் முழுமையடைந்த K கூட்டினைப் (1s2) பெற்றுள்ளது.
அயனிப் பிணைப்பு
தொகுஓர் அணுவிலிருந்து மற்றொரு அணுவிற்கு எலக்ட்ரான் பரிமாற்றம் அடைவதால் உருவாகும் நேர்மின் மற்றும் எதிர்மின் அயனிகளுகிடையே உள்ள நிலைமின் ஈர்ப்பு விசையின் காரணமாக உருவாகும் பிணைப்பு அயனிப் பிணைப்பு எனப்படும். இத்தகைய பிணைப்பைப் பெற்றுள்ள சேர்மங்கள் அயனிச் சேர்மங்கள் எனப்படுகின்றன. ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை இழக்கும் அணுக்கள் அல்லது அயனிகள் நேர்மின் அயனிகள் எனப்படும். இதேபோல ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை ஏற்கும் அணுக்கள் அல்லது அயனிகள் எதிர்மின் அயனிகள் எனப்படும். இந்த எலக்ட்ரான்களின் மாற்றம் இணைபிணைப்பெண் என்பதற்குப் பதிலாக மின் இணைதிறன் என்று அழைக்கப்படுகிறது. பொதுவாக உலோக அணுக்கள் நேர்மின் அயனியாகவும் அலோக அணுக்கள் எதிர்மின் அயனியாகவும் உள்ளன என்று கருதலாம். இதன்படி ஒரு உலோகத்திலிருந்து எலக்ட்ரான் அலோகத்திற்கு மாற்றப்பட்டு இரண்டு அணுக்களும் இனைதிறன் கூட்டில் முழுமையடைவதே அயனி பிணைப்பு என்றும் வரையறுக்கலாம்.
மிகவும் சிறியதாக இருக்கும் என்பதால் பெரும்பாலான மூலக்கூறுகளை வெறுங்கண்ணால் பார்க்க இயலாது. ஆனால் சில விதிவிலக்குகள் உள்ளன. டிஎன்ஏ,வை ஒரு பேரளவு மூலக்கூறாக பார்க்க இயலும் இதேபோல பல பாலிமர்களையும் பேரளவு மூலக்கூறுகளாக காணமுடியும்.
பொதுவாக கரிம தொகுப்புக்கான கட்டுமான அடுக்குகளாகப் பயன்படும் மூலக்கூறுகள் சில ஆங்சுடிராம் முதல் பல டசன் ஆங்சுடிராம் வரை பருமன் கொண்டவையாக அல்லது ஒரு மீட்டரில் பில்லியனில் ஒரு பங்கு அளவு பரிமாணத்தைக் கொண்டுள்ளன.
மேலே குறிப்பிட்டது போல பரிமாணமுள்ள ஒற்றை மூலக்கூறுகளை பொதுவாக ஒளியில் காணமுடியாது. ஆனால் சிறிய மூலக்கூறுகளையும் தனிப்பட்ட சில அணுக்களின் கோட்டு வரைபடத்தையும் சில சூழல்களில் அணு விசை நுண்ணோக்கியைப் பயன்படுத்தி கண்டுபிடிக்கலாம். சில பெரிய மூலக்கூறுகளை பேரளவு மூலக்கூறுகள் அல்லது மீமூலக்கூறுகள் எனப்படுகின்றன.
ஈரணு ஐதரசன் மிகச்சிறிய மூலக்கூறாக அடையாளம் காணப்பட்டுள்ளது. இவ்வணுவின் பிணைப்பு நீளம் 0.74 Å ஆகும் [16].
நிகர மூலக்கூற்று ஆரமே கரைசலில் ஒரு மூலக்கூறின் அளவு ஆகும்.[17][18]
மூலக்கூற்று வாய்ப்பாடுடன் வாய்ப்பாடுகள்
தொகுவேதி வாய்ப்பாட்டு வகைகள்
தொகுஒரு மூலக்கூறின் மூலக் கூற்று என்று சொல்லக் கூடிய பல பகுதிகளில் இந்த சம்பவத்தை ஊதிப் வாய்ப்பாட்டைக் குறிப்பிட வேதித் தனிமங்களின் குறியீடுகள், எண்கள் சில சமயங்களில் அடைப்புக்குறிகள், கோடுகள், அடைப்புக்குறிக்குள் கூட்டல் கழித்தல் குறியீடுகள் எண்கள் ஒரு மூலக்கூறின் தனித்துவத்தை உறுதிபடுத்த முடிவதில்லை டை என்ற மூலக்கூற்று நிறையைக் கணக்கிட ஒரு மிக எளிமையான ஒரு மிக எளிய வேதி வாய்ப்பாட்டு வகைகள் உண்டு இது கூட்டல் கழித்தல் குறியீடுகள் போன்றவற்றை ஒற்றை வரியில் பயன்படுத்தப்படுகின்றன. இந்த அடையாளச் சின்னங்களையும் அச்சுக்கலையின் பயன்பாட்டைக் கருத்திற்கொண்டு கீழ்க்குறியீடுகள் மற்றும் மேலெழுத்துக்களாக மட்டுமே பயன்படுத்தும் வகையில் கட்டுப்படுத்தப்பட்டுள்ளன.
ஒரு சேர்மத்தின் அனுபவ வாய்ப்பாடு என்பது ஒரு மிக எளிய வேதி வாய்ப்பாடு ஆகும். இவ்வாய்ப்பாட்டில் இடம்பெற்றுள்ள அணுக்களின் விகிதம் மிக எளிமையான முழு எண்களில் இருக்கும். உதாரணமாக தண்ணிரில் ஐதரசனும் ஆக்சிசனும் எப்போதும் 2:1 என்ற விகிதத்தில் இருக்கும். இதேபோல எத்தில் ஆல்ககாலில் கார்பன், ஐதரசன், ஆக்சிசன் மூன்றும் 2:6; 1 என்ற விகிதத்தில் சேர்ந்து உருவாகியிருக்கும். எனினும், அனுபவ வாய்ப்பாடைக் கொண்டு ஒரு மூலக்கூறின் தனித்துவத்தை உறுதிபடுத்த முடிவதில்லை. டை மெத்தில் ஈதரிலும் எத்தனாலில் உள்ள பகுதிப்பொருட்களின் விகிதமே இடம்பெற்றுள்ளது என்பது கவனிக்கத்தக்கது ஆகும். ஒரே மூலக்கூற்று வாய்ப்பாட்டையும் வேறுபட்ட கட்டமைப்பையும் கொண்ட சேர்மங்களை மாற்றியன்கள் என்பர். கார்போ ஐதரேட்டுகளிலும் ஒரே விகிதமும் வெவ்வேறு எண்ணிக்கையில் அணு எண்களும் கொண்ட சேர்மங்கள் காணப்படுகின்றன.
மூலக்கூற்று வாய்ப்பாடு ஒரு மூலக்கூறில் உள்ள அணுக்களின் எண்ணிக்கையை மிகச்சரியாக எடுத்துக் காட்டுகிறது. அதே வேளையில் அம்மூலக்கூறிலுள்ள அணுக்களையும் வேறுபடுத்திக் காட்டுகிறது. எனினும் வெவ்வேறு மாற்றியன்கள் வெவ்வேறு மூலக்கூறுகளாயிருந்தாலும் ஒரே வகையான அணுக்களால் ஆக்கப்பட்டுள்ளன. அனுபவ வாய்ப்பாடு பெரும்பாலும் மூலக்கூற்று வாய்ப்பாட்டோடு ஒத்திருந்தாலும் எப்போதும் ஒன்றாக இருப்பதில்லை. உதாரணமாக அசிட்டிலீன் மூலக்கூறு C2H2,என்ற மூலக்கூற்று வாய்ப்பாட்டால் எழுதப்படுகிறது. ஆனால், இதிலுள்ள தனிமங்களின் எளிய முழு எண் விகிதம் 1:1 ஆகும் (CH) வேதி வாய்ப்பாட்டிலிருந்து மூலக்கூற்று நிறையைக் கணக்கிட முடியும். வழக்கமான அணுநிறை அலகுகளில் இந்நிறை குறிப்பிடப்படுகிறது. கார்பன் 12 அணுவின் நிறையில் 1/12 பங்கு உள்ள நிறை அளவே ஒரு அணுநிலை அலகு ஆகும். வலைப்பின்னல் திண்மங்களுக்கு விகிதவியலில் வாய்ப்பாட்டு அலகு முறை பயன்படுகிறது.
அமைப்பு வாய்ப்பாடு
தொகுகுறிப்பாக நான்கு வெவ்வேறு தொகுதிகள் பிணைக்கப்பட்ட அணுக்கள், குறிப்பாக சிக்கலான முப்பரிமாண கட்டமைப்பைக் கொண்டுள்ள மூலக்கூறுகளை விளக்க ஒரு எளிய மூலக்கூற்று வாய்பாடு அல்லது அரை கட்டமைப்பு வேதியியல் வாய்ப்பாடு முற்றிலும் போதாது. இவ்வகையான நிகழ்வுகளில் அமைப்பு வாய்ப்பாடு முக்கியத்துவம் பெறுகிறது. அமைப்பு வாய்ப்பாடுகள் ஒரு பரிமாண வேதிப் பெயரையும் பல சொற்கள் கொண்ட பெயரிடு முறையையும் பயன்படுத்துகிறது.
மூலக்கூற்று வடிவியல்
தொகுஅதிர்வு மற்றும் சுழற்சி இயக்கங்கள் மூலம் தொடர்ச்சியாக இயங்கும் மூலக்கூறுகள், நிலையான சமநிலை வடிவம், பிணைப்பு நீளம் மற்றும் பிணைப்புக் கோணம் முதலியவற்றைக் கொண்டுள்ளன. ஒரு தூய்மையான பொருள் அதே சராசரி வடிவவியல் அமைப்பைக் கொண்ட மூலக்கூறுகளால் உருவாகியுள்ளது. ஒரு மூலக்கூறின் வேதிவாய்ப்பாடும், அதன் கட்டமைப்பும் அதன் வினைதிறனை உறுதிப்படுத்துதலில் முக்கியமான இரண்டு காரணிகளாகக் கருதப்படுகின்றன. மாற்றியன்கள் வேதி வாய்ப்பாட்டை பகிர்ந்து கொண்டாலும் அவற்றின் கட்டமைப்பு மாற்றம் காரணமாக வெவ்வேறு பண்புகளைக் கொண்டுள்ளன. ஒரு குறிப்பிட்ட வகை முப்பரிமாண மாற்றியன்கள் ஒரே மாதிரியான இயற்பியல், வேதியியல் பண்புகளைப் பெற்றிருந்தாலும் உயிர்வேதியியல் பண்புகளில் மாறுபடுகின்றன.
மூலக்கூற்று நிறமாலையியல்
தொகுஅறியப்பட்ட ஆற்றல் ஆய்வுகள் அல்லது பிளாங்கு மாறிலியின் அதிர்வெண்ணுடன் மூலக்கூறுகள் உண்டாக்கும் எதிர்வினையைப் பற்றி மூலக்கூற்று நிறமாலையியல் ஆய்வு செய்கிறது. மூலக்கூறுகள் அனைத்தும் குறைந்தபட்ச ஆற்றல் மட்டங்களைக் கொண்டுள்ளன. ஏற்பு அல்லது உமிழ்வு மூலமாக அம்மூலக்கூறின் ஆற்றல் பரிமாற்றத்தைக் கண்டுபிடிப்பதன் மூலம் இந்த ஆற்றல் மட்டங்களை ஆராய முடியும் [19].
படிகங்களில் நடப்பதைப்போல நியூட்ரான்கள், எலக்ட்ரான்கள், அல்லது உயர் ஆற்றல் எக்சு கதிர்களுடன் மூலக்கூறுகள் வழக்கமாக நிகழ்த்தும் இடைவினைகளின் போது, நிறமாலையியல் விளிம்புநிலை ஆய்வுகளில் கவனம் செலுத்துவதில்லை. மூலக்கூறுகளின் சுழற்சி வேறுபாடுகளை நுண்ணலை நிறமாலையியல் அளவிடுகிறது. புறவெளியிலுள்ள மூலக்கூறுகளை அடையாளம் காண இம்முறை பயன்படுகிறது. நீட்சி, வளைவு அல்லது திருப்ப இயக்கங்கள் உள்ளிட்ட மூலக்கூறுகளின் அதிர்வு மாற்றங்கள அகச்சிவப்பு நிறமாலையியல் அளவிடுகிறது. நுண்ணலை நிறமாலையியல் பொதுவாக மூலக்கூறுகளின் பிணைப்பு வகைகள் அல்லது வேதி வினைக்குழுக்களை அடையாளம் காணப் பயன்படுகிறது. எலக்ட்ரான் அமைப்புகளில் ஏற்படும் மாற்றங்கள், புற ஊதா, கட்புல அல்லது அண்மை அகச்சிவப்பு கதிர்களின் ஏற்பு அல்லது உமிழ்வு வரிகளில் வண்ணங்களை உண்டாக்குகின்றன. ஒரு மூலக்கூறில் உள்ள குறிப்பிட்ட உட்கருக்களை அணுக்கரு ஒத்திசைவு நிறமாலை ஆய்வு செய்கிறது. மூலக்கூறின் வெவ்வேறு நிலைகளில் உள்ள அணுக்களின் எண்ணிக்கையை அறிவதற்கு அணுக்கரு ஒத்திசைவு நிறமாலை ஆய்வைப் பயன்படுத்த முடியும்.
கருத்தாக்க அம்சங்கள்
தொகுமூலக்கூறு இயற்பியல் மற்றும் கோட்பாட்டு இரசாயனவியல் மூலம் மேற்கொள்ளப்படும் மூலக்கூறுகள் தொடர்பான ஆய்வு பெரும்பாலும் குவாண்டம் இயங்கியல் அடிப்படையில் அமைந்திருக்கிறது. வேதிப் பிணைப்புகளைப் பற்றி புரிந்து கொள்ள இது அவசியமாக உள்ளது.
ஐதரசன் மூலக்கூறிலுள்ள அயனியே மிகவும் சிறிய மூலக்கூறாகக் கருதப்படுகிறது. இதேபோல வேதிப்பிணைப்புகளிலும் மிகச்சிறியதாக ஓர் எலக்ட்ரான் பிணைப்பு ஆகும். எலக்ட்ரான் – எலக்ட்ரான் தள்ளுகை விசை இல்லாத காரணத்தால் இத்திட்டத்தின் சுரோடிங்கர் சமன்பாட்டிற்கு எளிதாக தீர்வு காணமுடியும் என்பது இதன் பொருளாகும். வேகமான எண்ணிம கணினிகள் வளர்ச்சியால், மிகவும் சிக்கலான மூலக்கூறுகளுக்கான தோராயமான தீர்வுகளை கண்டறிவது கணக்கீட்டு வேதியியலின் முக்கிய அம்சங்களில் ஒன்றாக உள்ளது.
ஒரு மூலக்கூறாக கருதுவதற்கு அணுக்களின் அமைப்பு போதுமான அளவுக்கு நிலையானதாக் உள்ளதா என்பதைக் கண்டறிய கடுமையான முயற்சிகள் மேற்கொள்ளப்பட்டது. ஐயுபிஏசி இதற்கான பரிந்துரைகளை அளிக்கிறது [4]. இவ்வரையறை அணுக்களுக்கிடையிலான இடைவினைகளின் தன்மையைப் பொறுத்ததல்ல ஆனால் அவற்றின் வலிமையை அடிப்படையாகக் கொண்டது ஆகும். உண்மையில், இது பலவீனமாக பிணைக்கப்பட்ட இனங்களை உள்ளடக்கியுள்ளது. ஈலியம் இருபடி போன்ற (He2) பாரம்பரியமாக மூலக்கூற்களாக கருதப்படாதவையும் இதில் அடங்கியுள்ளன. தாழ்வெப்பநிலைகளில் மட்டுமே இவற்றின் கட்டுண்ட நிலையை அறியமுடியும் [20].
ஒரு மூலக்கூறாகக் கருதப்படுவதற்கு போதுமான அணு அமைப்பு இருக்கிறதோ இல்லையோ, இயற்கையாகத் தத்துவரீதியாக அமைந்த ஒரு செயல்பாட்டு வரையறையாக இது உள்ளது. எனவே, மூலக்கூறு என்பது ஒரு அடிப்படை தனிப்பொருளல்ல. ஆனால் இதன் தத்துவம் அணுக்களுக்கு இடையிலான இடைவினைகளின் வலிமையை வேதியியலர்கள் அறிந்து கொள்ள உதவும் வழியாக பெரிதும் உதவுகிறது.
மேற்கோள்கள்
தொகு- ↑ Iwata, Kota; Yamazaki, Shiro; Mutombo, Pingo; Hapala, Prokop; Ondráček, Martin; Jelínek, Pavel; Sugimoto, Yoshiaki (2015). "Chemical structure imaging of a single molecule by atomic force microscopy at room temperature". Nature Communications 6: 7766. doi:10.1038/ncomms8766. பப்மெட்:26178193. Bibcode: 2015NatCo...6E7766I.
- ↑ Dinca, L. E.; De Marchi, F.; MacLeod, J. M.; Lipton-Duffin, J.; Gatti, R.; Ma, D.; Perepichka, D. F.; Rosei, F. (2015). "Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene". Nanoscale 7 (7): 3263–9. doi:10.1039/C4NR07057G. பப்மெட்:25619890. Bibcode: 2015Nanos...7.3263D.
- ↑ Hapala, Prokop; Švec, Martin; Stetsovych, Oleksandr; Van Der Heijden, Nadine J.; Ondráček, Martin; Van Der Lit, Joost; Mutombo, Pingo; Swart, Ingmar et al. (2016). "Mapping the electrostatic force field of single molecules from high-resolution scanning probe images". Nature Communications 7: 11560. doi:10.1038/ncomms11560. பப்மெட்:27230940.
- ↑ 4.0 4.1 தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "Molecule". Compendium of Chemical Terminology Internet edition.
- ↑ Ebbin, Darrell D. (1990). General Chemistry (3rd ed.). Boston: Houghton Mifflin Co. பன்னாட்டுத் தரப்புத்தக எண் 0-395-43302-9.
- ↑ Brown, T.L.; Kenneth C. Kemp; Theodore L. Brown; Harold Eugene LeMay; Bruce Edward Bursten (2003). Chemistry – the Central Science (9th ed.). New Jersey: Prentice Hall. பன்னாட்டுத் தரப்புத்தக எண் 0-13-066997-0.
- ↑ Chang, Raymond (1998). Chemistry (6th ed.). New York: McGraw Hill. பன்னாட்டுத் தரப்புத்தக எண் 0-07-115221-0.
- ↑ Zumdahl, Steven S. (1997). Chemistry (4th ed.). Boston: Houghton Mifflin. பன்னாட்டுத் தரப்புத்தக எண் 0-669-41794-7.
- ↑ Chandra, Sulekh (2005). Comprehensive Inorganic Chemistry. New Age Publishers. பன்னாட்டுத் தரப்புத்தக எண் 81-224-1512-1.
- ↑ "Molecule". பிரித்தானிக்கா கலைக்களஞ்சியம். (22 January 2016).
- ↑ Harper, Douglas. "molecule". Online Etymology Dictionary. பார்க்கப்பட்ட நாள் 2016-02-22.
- ↑ "molecule". Merriam-Webster. பார்க்கப்பட்ட நாள் 22 February 2016.
- ↑ Molecule Definition (Frostburg State University)
- ↑ "The Hutchinson unabridged encyclopedia with atlas and weather guide". worldcat.org. Oxford, England. பார்க்கப்பட்ட நாள் 28 February 2016.
- ↑ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. பன்னாட்டுத் தரப்புத்தக எண் 0-13-250882-6. பார்க்கப்பட்ட நாள் 2012-02-05.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Roger L. DeKock; Harry B. Gray; Harry B. Gray (1989). Chemical structure and bonding. University Science Books. p. 199. பன்னாட்டுத் தரப்புத்தக எண் 0-935702-61-X.
- ↑ Chang RL; Deen WM; Robertson CR; Brenner BM. (1975). "Permselectivity of the glomerular capillary wall: III. Restricted transport of polyanions". Kidney Int. 8 (4): 212–218. doi:10.1038/ki.1975.104. பப்மெட்:1202253. https://archive.org/details/sim_kidney-international_1975-10_8_4/page/212.
- ↑ Chang RL; Ueki IF; Troy JL; Deen WM; Robertson CR; Brenner BM. (1975). "Permselectivity of the glomerular capillary wall to macromolecules. II. Experimental studies in rats using neutral dextran". Biophys J. 15 (9): 887–906. doi:10.1016/S0006-3495(75)85863-2. பப்மெட்:1182263. Bibcode: 1975BpJ....15..887C.
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "Spectroscopy". Compendium of Chemical Terminology Internet edition.
- ↑ Anderson JB (May 2004). "Comment on "An exact quantum Monte Carlo calculation of the helium-helium intermolecular potential" [J. Chem. Phys. 115, 4546 (2001)]". J Chem Phys 120 (20): 9886–7. doi:10.1063/1.1704638. பப்மெட்:15268005. Bibcode: 2004JChPh.120.9886A.
குறிப்புகள்
தொகுPauling, Linus (1970). General Chemistry. New York: Dover Publications, Inc. பன்னாட்டுத் தரப்புத்தக எண் 0-486-65622-5.
Ebbin, Darrell, D. (1990). General Chemistry, 3th Ed. Boston: Houghton Mifflin Co. பன்னாட்டுத் தரப்புத்தக எண் 0-395-43302-9.{{cite book}}: CS1 maint: multiple names: authors list (link)
Brown, T.L. (2003). Chemistry – the Central Science, 9th Ed. New Jersey: Prentice Hall. பன்னாட்டுத் தரப்புத்தக எண் 0-13-066997-0.
Chang, Raymond (1998). Chemistry, 6th Ed. New York: McGraw Hill. பன்னாட்டுத் தரப்புத்தக எண் 0-07-115221-0.
Zumdahl, Steven S. (1997). Chemistry, 4th ed. Boston: Houghton Mifflin. பன்னாட்டுத் தரப்புத்தக எண் 0-669-41794-7.