குளோரேட்டு
குளோரேட்டு (Chlorate) எதிர்மின் அயனியின் மூலக்கூற்று ஆகும்வாய்ப்பாடு ClO−3 ஆகும். இந்த எதிர்மின் அயனியில் குளோரின் +5 என்ற ஆக்சிசனேற்ற நிலையில் உள்ளது. குளோரேட்டு எதிர்மின் அயனியைக் கொண்டுள்ள எந்த வேதிச் சேர்மத்தையும் ஒரு குளோரேட்டு என்று வரையறுக்கலாம். குளோரிக் அமிலத்தின் உப்புகள் பொதுவாக குளோரேட்டுகள் என்றழைக்கப்படுகின்றன. குளோரேட்டு என்ற சொல்லுடன் உரோமன் எண் அடைப்புக் குறிக்குள் கொடுக்கப்படுகிறது. உதாரணமாக குளோரேட்டு(VII) என்பது ஒரு குறிப்பிட்ட குளோரினுடைய ஆக்சி எதிர்மின் அயனியாகும்.
CAS # 14866-68-3[1]
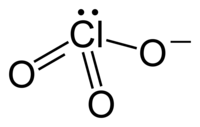
இணைதிறன் கூடு எலக்ட்ரான் இணை தள்ளுகை கொள்கையில் முன் கணிக்கப்பட்டபடி குளோரேட்டு அயனிகள் முக்கோண பட்டைக்கூம்பு வடிவத்தில் உள்ளன.
குளோரேட்டுகள் வலிமையான ஆக்சிசனேற்றிகள் என்பதால் அவை எளிதில் ஆக்சிசனேற்றமடையும் பொருள்கள் மற்றும் கரிம வேதியியல் பொருட்களிடமிருந்து தொடர்பு கொள்ளாத வகையில் தொலைவாக தள்ளி வைக்கப்படவேண்டும். குளோரேட்டு உப்பின் கலவைகளுடன் சர்க்கரை, மரத்தூள், மரக்கரி, கரிமக் கரைப்பான்கள், உலோகங்கள் போன்ற கிட்டத்தட்ட எரியும் பொருட்கள் தொடர்பு கொள்ள நேரிட்டால் உடனடியாக எரிவிக்கப்படுகின்றன. இந்த காரணத்திற்காகவே ஒரு காலத்தில் வானவேடிக்கை பொருட்களில் குளோரேட்டுகள் பயன்படுத்தப்பட்டன. இருப்பினும் இவற்றின் நிச்சயமற்ற நிலைப்புத்தன்மை காரணமாக இவற்றின் பயன்பாடுகள் குறைந்து விட்டன. முன்னதாக குளோரேட்டுகளை பயன்படுத்தி வந்த பயன்பாடுகளில் தற்போது பெர்குளோரேட்டுகள் பயன்படுத்தப்படுகின்றன.
குளோரேட்டு அயனியை ஒரு லூயிசு கட்டமைப்பால் திருப்திகரமாக பிரதிநிதித்துவப்படுத்த முடியாது, ஏனெனில் அனைத்து Cl-O பிணைப்புகளும் ஒரே நீளம் கொண்டுள்ளன. பொட்டாசியம் குளோரேட்டில் அனைத்து Cl-O பிணைப்புகளும் 1.49 ஆங்சிட்ராங் நீளம் கொண்டவையாகும். இங்கு குளோரின் அணு மீயிணைதிறன் கொண்டதாக உள்ளது. அதற்கு பதிலாக இது பெரும்பாலும் பல அதிர்வு கட்டமைப்புகளின் கலப்பினமாக கருதப்படுகிறது.
தயாரிப்பு
தொகுஆய்வகம்
தொகுபொட்டாசியம் ஐதராக்சைடு போன்ற ஓர் உலோக ஆக்சைடுடன் குளோரின் வாயுவை சேர்த்து குளோரேட்டுகள் தயாரிக்கப்படுகின்றன.
- 3 Cl2 + 6 KOH → 5 KCl + KClO3 + 3 H2O
இவ்வினையில் குளோரின் விகிதச்சமமாதலின்றி ஒடுக்கம் மற்றும் ஆக்சிசனேற்றம் ஆகிய இரண்டு வினைகளிலும் ஈடுபடுகிறது. ஆக்சிசனேற்ற நிலை பூச்சியத்தில் உள்ள குளோரின் -1 என்ற ஆக்சிசனேற்ற நிலையிலுள்ள குளோரேட்டாகவும் மற்றும் ஆக்சிசனேற்ற எண் +5 இல் உள்ள குளோரேட்டு(V) ஆகவும் உருவாகிறது. இதற்குப் பதிலாக குளிர்ந்த நீரிய உலோக ஐதராக்சைடுகள் குளோரின் வாயுவுடன் வினைபுரியும்போது குளோரைடும் ஐப்போகுளோரைட்டும் உருவாகின்றன.
தொழிற்துறை தயாரிப்பு
தொகுதொழில் முறையில் குளோரேட்டு தயாரிக்கும் தயாரிப்பு முறை குளோரின் வாயுவுக்குப் பதிலாக நீரிய சோடியம் குளோரைடு கரைசலில் தொடங்குகிறது. மின்னாற்பகுப்பிற்கான உபகரணங்கள் குளோரின் மற்றும் சோடியம் ஐதராக்சைடு இரண்டையும் கலக்க அனுமதித்தால், மேலே விவரிக்கப்பட்ட விகிதச்சமமாதலின்மை வினை நிகழ்கிறது.
இயற்கை தோற்றம்
தொகுஉலகெங்கிலும் இயற்கையான குளோரேட்டு படிவுகள் இருப்பதைக் சமீபத்திய ஆய்வு கண்டறிந்துள்ளது, வறண்ட மற்றும் உயர் வறண்ட பகுதிகளில் ஒப்பீட்டளவில் அதிக செறிவுடன் குளோரேட்டு படிவுகள் காணப்படுகின்றன [2]. பெர்குளோரேட்டை ஒத்த குளோரேட்டின் அளவுக்கு மழை மாதிரிகளிலும் குளோரேட்டு அளவிடப்பட்டது. குளோரேட்டு மற்றும் பெர்குளோரேட்டு இரண்டும் ஒரு பொதுவான இயற்கை உருவாக்க பொறிமுறையைப் பகிர்ந்து கொள்ளலாம் என்றும் மற்றும் குளோரின் உயிர் வேதியியல் சுழற்சியின் ஒரு பகுதியாக இவை இருக்கலாம் என்றும் சந்தேகிக்கப்படுகிறது. ஒரு நுண்ணுயிர் நிலைப்பாட்டில் இருந்து நோக்குகையில், இயற்கை குளோரேட்டின் இருப்பு குளோரேட்டை குளோரைட்டுக்குக் குறைக்கும் திறன் கொண்ட பல்வேறு வகையான நுண்ணுயிரிகள் உள்ளன என்பதையும் விளக்கக்கூடும். மேலும், குளோரேட்டு குறைக்கப்படும் பரிணாமம் ஒரு பண்டைய நிகழ்வாக இருக்கலாம், ஏனெனில் இன்றுவரை விவரிக்கப்பட்டுள்ள அனைத்து பெர்குளோரேட்டுகளையும் குறைக்கும் பாக்டீரியாக்கள் குளோரேட்டை ஒரு முனைய எலக்ட்ரான் ஏற்பியாகப் பயன்படுத்துகின்றன [3]. இது தெளிவாகக் கூறப்பட வேண்டும், தற்போது குளோரேட்டு ஆதிக்கம் செலுத்தும் தாதுக்கள் எதுவும் தற்போது தெரியவில்லை என்பதை . இதன் பொருள் குளோரேட்டு எதிர்மின் அயனியின் அறியப்பட்ட கனிம இனங்களில் மாற்றாக மட்டுமே இது உள்ளது, அல்லது இறுதியில் - துளை நிரப்பும் கரைசல்களில் இது உள்ளது [4].
2011 ஆம் ஆண்டு மேற்கொள்ளப்பட்ட ஓர் ஆய்வில் சியார்ச்சியா தொழில் நுட்ப நிறுவனம் புதன் கோளில் மக்னீசியம் குளோரேட்டு இருக்கிறது என்ற செய்தியை வெளியிட்டுள்ளது [5].
சேர்மங்கள்
தொகு- பொட்டாசியம் குளோரேட்டு, KClO3
- சோடியம் குளோரேட்டு, NaClO3
- மக்னீசியம் குளோரேட்டு, Mg(ClO3)2 போன்ற உப்புகள் குளேரேட்டுகளுக்கு உதாரணமாகும்.
பிற ஆக்சியெதிர்மின் அயனிகள்
தொகுகுளோரேட்டு என்ற சொல்லை தொடர்ந்து ரோமன் எண்ணியமுறை எண் ஒன்று குறிப்பிடப்படுமேயானால் அது ஆக்சியெதிர்மின் அயனியில் குளோரினின் ஆக்சிசனேற்ற நிலை ரோமன் எண்ணிய முறையின் மதிப்பிலேயே இருக்கும்.
| பொதுப்பெயர் | இருப்பின் பெயர் | ஆக்சிசனேற்ற நிலை | வாய்ப்பாடு |
|---|---|---|---|
| ஐப்போகுளோரைட்டு]] | குளோரேட்டு(I) | +1 | ClO− |
| குளோரைட்டு | குளோரேட்டு(III) | +3 | ClO− 2 |
| 'குளோரேட்டு' | 'குளோரேட்டு(V)' | +5 | ClO− 3 |
| பெர்குளோரேட்டு]] | குளோரேட்டு(VII) | +7 | ClO− 4 |
மேற்கண்ட விவாதங்களின் இறுதியாக குளோரேட்டு என்பதன் பொருள் எந்தவொரு ஆக்சியெதிர்மின் அயனியையும் குறிக்கும். அதிலும் குறிப்பாக குளோரின் +5 என்ற ஆகிசனேற்ற நிலையில் இருக்க வேண்டும் என்பதாகும்.
நச்சு இயல்
தொகுஒப்பீட்டளவில் குளோரேட்டுகள் நச்சுத்தன்மை கொண்டவையென விவரிக்கப்படுகிறது. ஒடுக்கும்போது இவை தீங்கற்ற குளோரைடுகளைக் கொடுக்கின்றன.
மேற்கோள்கள்
தொகு- ↑ "ChemIndustry". பார்க்கப்பட்ட நாள் 9 April 2014.
- ↑ Rao, B.; Hatzinger, P. B.; Böhlke, J. K.; Sturchio, N. C.; Andraski, B. J.; Eckardt, F. D.; Jackson, W. (2010). "Natural Chlorate in the Environment: Application of a New IC-ESI/MS/MS Method with a Cl18O3− Internal Standard". Environ. Sci. Technol. 44: 8429–8434. doi:10.1021/es1024228. பப்மெட்:20968289. Bibcode: 2010EnST...44.8429R.
- ↑ Coates, J. D.; Achenbach, L. A. (2004). "Microbial perchlorate reduction: rocket-fuelled metabolism". Nature Reviews Microbiology 2 (July): 569–580. doi:10.1038/nrmicro926. பப்மெட்:15197392.
- ↑ http://www.mindat.org
- ↑ https://www.letemps.ch/sciences/2015/09/28/eau-liquide-reperee-pentes-martiennes
வெளி இணைப்புகள்
தொகு- "Chlorates". பிரித்தானிக்கா கலைக்களஞ்சியம் (11th) 6. (1911).