மூலிகம்
வேதியியலில், மூலிகம் (Radical) அல்லது கட்டுறாத மூலிகம் (Free Radical) என்பது சோடியாக்கப்படாத வலுவளவு எதிர்மின்னியைக் கொண்டுள்ள அணு, மூலக்கூறு அல்லது அயனி ஆகும்.[1] சோடியாக்கப்படா எதிர்மின்னிகள் இருப்பதால் பெரும்பாலான கட்டுறா மூலிகங்கள் உயர் வேதித் தாக்குதிறன் கொண்டவை.[2] பெரும்பாலான கட்டுறா மூலிகங்கள் தன்னிச்சையாக இருபகுதியங்களாகிக் கொள்ளும். பெரும்பாலான கரிம மூலிகங்களின் ஆயுட்காலம் மிகக்குறைவாகும்.
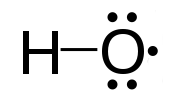
கட்டுறாத மூலிகத்திற்கான எடுத்துக்காட்டாக, ஒட்சிசன் அணுவில் சோடியாக்கப்படாத ஓர் எதிர்மின்னியைக் கொண்டுள்ள ஐதரொட்சைல் மூலிகத்தை (HO•) எடுத்துக்கொள்ளலாம்.
தாழ்த்தல்-ஏற்றத் தாக்கங்கள், அயனியாக்கும் கதிர்ப்பு, வெப்பம், மின்னிறக்கங்கள், மின்பகுப்பு போன்ற செய்முறைகளின்போது மூலிகங்கள் உருவாக்கப்படுவதுண்டு. பெரும்பாலான வேதித் தாக்கங்களில் மூலிகங்கள் இடைநிலைகளாகச் செயற்படுவதால், சமப்படுத்திய சமன்பாடுகளில் இவை இடம்பெறுவது குறைவு.
தகனம், வளிமண்டல வேதியியல், பல்பகுதியாக்கம், மின்ம வேதியியல், உயிர்வேதியியல் போன்ற பல்வேறு வேதிச் செயன்முறைகளில் கட்டுறா மூலிகங்கள் பங்குபற்றுகின்றன. உயரினங்களில், கட்டுறா மூலிகங்களான சுப்பரொட்சைட்டும் நைத்திரிக்கு ஒட்சைட்டும் குருதி அழுத்தம் உட்படப் பல்வேறு செயற்பாடுகளைக் கட்டுப்படுத்துகின்றன.
வேதித் தாக்கங்களில்
தொகுவேதிச் சமன்பாடுகளில், அணுக் குறியீட்டுக்கோ மூலக்கூற்று வாய்பாட்டுக்கோ வலப்பக்கத்தில் ஒரு புள்ளியை இடுவதன் மூலம் கட்டுறா மூலிகங்கள் பொதுவாக அடையாளப்படுத்தப்படுகின்றன.
- குளோரின் வளிமமானது புறவூதாக் கதிர்களின் முன்னிலையில் குளோரின் அணு மூலிகங்களாகப் பிரிகையடையும். இம்முறை அற்கேன்களைக் குளோரினேற்றப் பயன்படுத்தப்படுகின்றது.[3]
மூலிகத் தாக்கப் பொறிமுறைகளில் தனி எதிர்மின்னிகளின் நகர்வைக் காட்ட ஒருதலை அம்புக்குறிகள் பயன்படுத்தப்படும்:
உருவாக்கம்
தொகுமூலிகங்களைத் தோற்றுவிப்பதற்கு, சமப்பகுப்பின் மூலம் பங்கீட்டுவலுப் பிணைப்புகளை உடைக்க வேண்டிய தேவை இருக்கலாம். கூடிய ஆற்றல் இதற்குத் தேவைப்படும். ΔH° என்ற குறியீட்டின் மூலம் இச்சமப்பகுப்புப் பிணைப்புப் பிரிகை ஆற்றல்கள் குறித்துக்காட்டப்படும். எடுத்துக்காட்டாக, H2 ஐ 2H• ஆகப் பிரிகையடையச் செய்வதற்கு ΔH° = +435 kJ·mol-1 தேவைப்படும். அதேவேளை, Cl2 ஐ 2Cl• ஆகப் பிரிகையடையச் செயவதற்கு ΔH° = +243 kJ·mol-1 தேவைப்படும்.[4]
பல்பகுதியாக்கம்
தொகுபெரும்பாலான பல்பகுதியாக்கத் தாக்கங்களில் கட்டுறா மூலிகங்களும் பங்குபற்றுகின்றன. பெரும்பாலான நெகிழிகளும் மிளிரிகளும் மூலிகப் பல்பகுதியாக்கத்தின் மூலம் உருவாக்கப்படுகின்றன.
வளிமண்டல மூலிகங்கள்
தொகுகீழ் வளிமண்டலத்தில் கூடுதலாக உள்ள மூலிகம், மூலக்கூற்று ஈரொட்சிசன் ஆகும். கீழ் வளிமண்டலத்தில், நைதரசன் ஈரொட்சைட்டின் ஒளிப்பகுப்பின் மூலம் ஒட்சிசன் அணுவும் நைத்திரிக்கு ஒட்சைட்டும் உருவாக்கப்படுகின்றன. இச்செயன்முறை புகைப்பனி உருவாக்கத்திற்குக் காரணமாக அமைகின்றது. இதே போல, ஓசோனின் ஒளிப்பகுப்பு, அருட்டிய ஒட்சிசன் அணுவைத் தோற்றுவிக்கும்.
மேல் வளிமண்டலத்தில், ஞாயிற்றுப் புறவூதாக் கதிர்ப்பின் முன்னிலையில், குளோரோபுளோரோகாபன்கள், குளோரின் மூலிகத்தைத் தோற்றுவிக்கும். இது ஓசோனை ஒட்சிசனாக மாற்றும் தாக்கத்தை ஊக்குவிப்பதால், ஓசோன் படைத் தேய்வுக்குக் காரணமாக அமைகின்றது.[5] இதன் காரணமாக, குளிர் பதனூட்டிகளில் குளோரோபுளோரோகாபன்களின் பயன்பாடு வரையறுக்கப்பட்டுள்ளது.
- |
வரலாறு
தொகு20 ஆம் நூற்றாண்டின் இறுதி பிற்பகுதி வரை, பெரிய மூலக்கூறுகளின் பகுதியாகவோ சொந்த மூலக்கூறாகவோ எவ்வாறிருப்பினும், மெத்தைல் கூட்டம், காபொட்சைல் போன்ற பிணைக்கப்பட்ட அணுக்கூட்டங்களைக் குறிக்க, மூலிகம் என்ற சொல் பயன்படுத்தப்பட்டது. அண்மைய பெயரீட்டு முறைகளின்படி, பெரிய மூலக்கூற்றின் பகுதியானது, தொழிற்பாட்டுக் கூட்டம் அல்லது பதிலி என அழைக்கப்படுகின்றது. மூலிகம் என்பது கட்டுறாதவற்றையே குறிக்கின்றது.
முதலில் கண்டறியப்பட்ட கட்டுறாத கரிம மூலிகம் முப்பீனைல் மெத்தைல் மூலிகம் ஆகும். இது 1900 ஆம் ஆண்டு மோசசு கோம்பேகால் கண்டறியப்பட்டது.[6]
இதனையும் பார்க்க
தொகுமேற்கோள்கள்
தொகு- ↑ "radical (free radical)". IUPAC Compendium of Chemical Terminology. 2014. doi:10.1351/goldbook.R05066. http://www.iupac.org/goldbook/R05066.pdf. பார்த்த நாள்: 2018-05-31.
- ↑ V. Lobo, A. Patil, A. Phatak and N. Chandra (சூலை - திசம்பர் 2010). "Free radicals, antioxidants and functional foods: Impact on human health". Pharmacognosy Review 4 (8): 118 - 126. doi:10.4103/0973-7847.70902. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3249911/.
- ↑ க.பொ.த உயர்தரம் (இரசாயனவியல்) ஆசிரியர் அறிவுரைப்பு வழிகாட்டி (மீள்நோக்கப்பட்டது) தரங்கள் 12 & 12 (PDF). தேசிய கல்வி நிறுவகம். 2012. pp. 120–121.
- ↑ Tadashi Okuyama, Howard Maskill (2013). Organic Chemistry: A Mechanistic Approach. OUP Oxford. p. 446. பன்னாட்டுத் தரப்புத்தக எண் 9780199693276.
- ↑ James W. Elkins (1999). The Chapman & Hall Encyclopedia of Environmental Science. Boston, MA: Kluwer Academic. pp. 78–80.
- ↑ "Gomberg's discovery". University of Bristol. பார்க்கப்பட்ட நாள் 31 மே 2018.