ஆக்சலேட்டு
ஆக்சலேட்டு (Oxalate) என்பது C
2O2−
4, என்ற மூலக்கூற்று வாய்ப்பாடு அல்லது (COO)2−
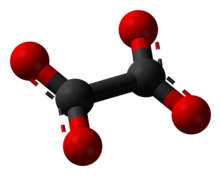
2 என்ற அமைப்பு வாய்ப்பாடு கொண்ட ஒரு ஈரெதிர்மின் அயனியாகும். ஐயுபிஏசி முறையில் இவவயனியை எத்தேன்டையோயேட்டு என்று அழைக்கிறார்கள். ஆக்சாலிக் அமிலத்தின் உப்பான இந்த அயனிகளை இரண்டு பெயர்களாலும் அழைக்கலாம். உதாரணமாக சோடியம் ஆக்சலேட்டு ( Na2C2O4,), டைமெத்தில் ஆக்சலேட்டு ((CH3)2C2O4). ஆக்சலேட்டுகள் ஒருங்கிணைவுச் சேர்மங்களையும் உருவாக்குகின்றன. இங்கு சுருக்கமாக இவை ஆக்சு என்ற சுருக்கப்பெயரால் அழைக்கப்படுகின்றன.

பல உலோக அயனிகள் ஆக்சலேட்டுடன் வினைபுரிந்து கரையாத வீழ்படிவுகலாக உருவாகின்றன. முக்கியமான உதாரணமாக கால்சியம் ஆக்சலேட்டு சேர்மத்தைக் கூறலாம். இதுவே சிறுநீரகக் கற்களில் காணப்படும் முதன்மையான பகுதிப்பொருளாகும்.
ஆக்சாலிக் அமிலத்துடன் தொடர்பு
தொகுஆக்சாலிக் அமிலத்திலிருந்து பலபடிநிலைகளில் புரோட்டான் பிரிகையடைந்து பாலிபுரோட்டிக் அமிலங்களாகின்றன. ஒரு புரோட்டான் இழப்பு ஏற்படும் போது ஒற்றை இணைதிற ஐதரசன் ஆக்சலேட்டு எதிர்மின்னயனி HC
2O−
4. உருவாகிறது.
இந்த எதிர்மின் அயனியுடன் சேரும் உப்பு சிலசமயங்களில் அமில ஆக்சலேட்டு, ஒற்றைக்கார ஆக்சலேட்டு ஆல்லது ஐதரசன் ஆக்சலேட்டு என்ற பெயரால் அழைக்கப்படுகிறது. முதலாவது புரோட்டான் இழக்கும்போது சமநிலை மாறிலியின் மதிப்பு(Ka) 5.37 × 10−2 (pKa = 1.27) ஆகும். இரண்டாவது புரோட்டனை இழக்கும்போது ஆக்சலேட்டு அயனியை உருவாக்குகிறது. சமநிலை மாறிலியின் மதிப்பு(Ka) 5.25 × 10−5 (pKa = 4.28) ஆகும். நடுநிலை காரக்காடித்தன்மை ( pH) கரைசல்களில் இந்த சமநிலை மாறிலியின் மதிப்புகள் ஆக்சாலிக் அமிலமல்ல என்றும் மிகச்சிறிதளவில் ஐதரசன் ஆக்சலேட்டு மட்டுமே காணப்படுவதாகவும் சுட்டிக் காட்டுகின்றன [1]. பெரும்பாலும் H2C2O4, HC2O−4, மற்றும் C2O2−4,ஆகிய மூன்றையும் தெளிவாக வேறுபடுத்திக் காட்டவில்லை என்றாலும் இம்மூன்றின் கலவையை ஆக்சாலிக் அமிலம் என்கிறார்கள்.
கட்டமைப்பு
தொகுஎளிய ஆக்சலேட்டு உப்புகளில் இருக்கும் ஆக்சலேட்டு எதிர்மின் அயனிகள் D2h மூலக்கூற்று சமச்சீர்மை கொண்ட சமதள முப்பரிமாண அமைப்பை ஏற்கின்றன. அல்லது 90° அணுகுமுறையில் O–C–C–O இருமுகங்கள் தோராயமாக D2d சமசீர்மையை ஏற்கின்றன [2]. என்று எக்சுகதிர் படிகவியல் ஆய்வுகள் தெரிவிக்கின்றன.
குறிப்பாக M2C2O4 கட்டமைப்பு திண்மங்களில் ஆக்சலேட்டு பகுதிக் கூறுகள் சமதள D2h முப்பரிமாண அமைப்பை ஏற்கின்றன. (M = Li, Na, K) [3][4] எனினும் சேர்மம் Cs2C2O4 இல் O–C–C–O இருதளமிடைக் கோணம் 81(1)° ஆக இருக்கிறது. எனவே Cs2C2O4 தோராயமாக D2d சமசீர்மைக்கு மிக நெருக்கமாக உள்ளது. ஏனெனில் இரண்டு CO2 சமதளங்கள் எதிரெதிராக உள்ளன. சேர்மம் Rb2C2O4 இன் இரண்டு வடிவங்களில் ஒன்று சமதள முப்பரிமாணமும் மற்றொன்று எதிரெதிர் ஆக்சலேட்டாகவும் காணப்படுகிறது.
ஆக்சலேட்டு அயனி இணைந்துள்ள கார உலோகங்களின் அளவைப் பொறுத்தே அவை ஏற்கின்ற முப்பரிமாணங்களும் அமைகின்றன என்பதையே உதாரனங்கள் காட்டுகின்றன, அவற்றில் சில மைய C−C பிணைப்புகளின் சுழற்சிக்குத் தடையாக உள்ளன. கணக்கீட்டு முறைகளின் படிஉ இத்தடையை அளவிட்டால் தனி ஈரயனியின் மதிப்பு 2-6 கிலோகலோரிகள்/மோல் ஆக உள்ளது [5][6][7]. மத்திய கார்பன் – கார்பன் பிணைப்பு சிறந்த ஒற்றைப் பிணைப்பாக காணப்படுகிறது என்று இத்தகைய முடிவுகள் பொருள் விளக்கம் அளிக்கின்றன, மேலும் இரண்டு CO−2 அலகுகளிடையில் குறைவான பை ஊடாட்டம் மட்டுமே உள்ளது எனவும் அறியப்படுகிறது [2] .சமதள முப்பரிமாணம் மற்றும் எதிரெதிர் பரிமாணம் இவற்றுக்கு இடையிலான ஆற்றல் வித்தியாசமாகக் கருதப்படும் C−C பிணைப்புச் சுழற்சிக்கான தடை இயல்பாகவே நிலைமின் விசையாகும். சமதள வடிவத்தில் O−O பிணைப்பை இவ்விசை பெருமளவுக்கு விலக்கி ஒதுக்குகிறது.
பொட்டாசியம் ஃபெர்ரியாக்சலேட்டு போன்ற சேர்மங்களில் ஆக்சலேட்டு பெரும்பாலும் இருபல் இடுக்கியிணைப்பு ஈந்தணைவியாகக் காணப்படுகிறது. ஒற்றை உலோக மையங்களுடன் இடுக்கி இணைப்பு சேரும்போதெல்லாம் சமதள முப்பரிமாணத்தையே ஏற்கின்றன.
இயற்கைத் தோற்றம்
தொகுஇயற்கையில் பல தாவரங்களில் ஆக்சலேட்டு தோன்றுகிறது. கார்போவைதரேட்டுகளின் நிறைவடையாத ஆக்சிசனேற்றத்தால் இவை தோன்றுகின்றன. சில வகை கோதுமைகளில் ஆக்சாலிக் அமிலம் காணப்படுகிறது [8].
பாதுகாப்பு
தொகுஉடலில் ஆக்சலேட்டு அளவு அதிகரிக்கும் போது சிறுநீரக நோய்கள் தோன்றி உயிருக்கு ஆபத்து விலைவிக்கின்றன.
மேற்கோள்கள்
தொகு- ↑ Riemenschneider, Wilhelm; Tanifuji, Minoru (2000). "Oxalic Acid". Ullmann's Encyclopedia of Industrial Chemistry. எண்ணிம ஆவணச் சுட்டி:10.1002/14356007.a18_247. பன்னாட்டுத் தரப்புத்தக எண் 3-527-30673-0.
- ↑ 2.0 2.1 Dean, Philip A. W. (2012). "The Oxalate Dianion, C
2O2−
4: Planar or Nonplanar?". Journal of Chemical Education 89 (3): 417–418. doi:10.1021/ed200202r. Bibcode: 2012JChEd..89..417D. https://archive.org/details/sim_journal-of-chemical-education_2012-03_89_3/page/417. - ↑ Reed, D. A.; Olmstead, M. M. (1981). "Sodium oxalate structure refinement". Acta Crystallographica Section B 37 (4): 938–939. doi:10.1107/S0567740881004676.
- ↑ Beagley, B.; Small, R. W. H. (1964). "The structure of lithium oxalate". Acta Crystallographica 17 (6): 783–788. doi:10.1107/S0365110X64002079.
- ↑ Clark, Timothy; Schleyer, Paul von Ragué (1981). "Conformational preferences of 34 valence electron A2X4 molecules: Anab initio Study of B2F4, B2Cl4, N2O4, and C
2O2−
4". Journal of Computational Chemistry 2: 20–29. doi:10.1002/jcc.540020106. https://archive.org/details/sim_journal-of-computational-chemistry_1981_spring_2_1/page/20. - ↑ Dewar, Michael J.S.; Zheng, Ya-Jun (1990). "Structure of the oxalate ion". Journal of Molecular Structure: THEOCHEM 209: 157–162. doi:10.1016/0166-1280(90)85053-P.
- ↑ Herbert, John M.; Ortiz, J. V. (2000). "Ab Initio Investigation of Electron Detachment in Dicarboxylate Dianions". The Journal of Physical Chemistry A 104 (50): 11786–11795. doi:10.1021/jp002657c.
- ↑ Streitweiser, Andrew, Jr.; Heathcock, Clayton H. (1976). Introduction to Organic Chemistry. Macmillan. p. 737.
{{cite book}}: CS1 maint: multiple names: authors list (link)
மேலும் வாசிக்க
தொகு- Euler. "Ksp Table: Solubility product constants near 25 °C". chm.uri.edu (in English). பார்க்கப்பட்ட நாள் 10 June 2021.
{{cite web}}: CS1 maint: unrecognized language (link) - Ibis, Fatma; Dhand, Priya; Suleymanli, Sanan; van der Heijden, Antoine E. D. M.; Kramer, Herman J. M.; Eral, Huseyin Burak (2020). "A combined experimental and modelling study on solubility of calcium oxalate monohydrate at physiologically relevant pH and temperatures". Crystals 10 (10): 924. doi:10.3390/cryst10100924. பன்னாட்டுத் தர தொடர் எண்:2073-4352. https://repository.tudelft.nl/islandora/object/uuid%3Ada7c34f4-d312-457c-8960-da91b7472244/datastream/OBJ/download.
- Ulmgren, Per; Rådeström, Rune (1999). "Solubility of calcium oxalate in the presence of magnesium ions, and solubility of magnesium oxalate in sodium chloride medium". Nordic Pulp & Paper Research Journal 14 (4): 330–335. doi:10.3183/npprj-1999-14-04-p330-335. பன்னாட்டுத் தர தொடர் எண்:2000-0669.
வெளி இணைப்புகள்
தொகு- Oxalate.org - Oxalate content of 750+ foods from university and government sources