ஐதராக்சைடு
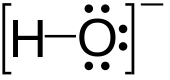
ஐதராக்சைடு (Hydroxide) என்பது OH− என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஓர் ஈரணு அயனியாகும். இந்த அயனி ஓர் எதிர் மின்சுமையைக் கொண்டுள்ளது. ஓர் ஐதரசன் அணுவும் ஓர் ஆக்சிசன் அணுவும் சகப்பிணைப்பால் பிணைக்கப்பட்டு இந்த அயனி உருவாகிறது. தண்ணீரின் ஒரு முக்கியமான பகுதிப் பொருளாக இது சிறிதளவு கலந்துள்ளது. ஒரு காரமாக, ஈனியாக, கருக்கவர்பொருளாக மற்றும் ஒரு வினைவேகமாற்றியாக ஐதராக்சைடு அயனி செயல்படுகிறது. ஐதராக்சைடு அயனி உப்புகளை உருவாக்குகிறது. இவற்றில் சில உப்புகள் நீரிய கரைசலில் பிரிகையடைந்து கரைப்பானேற்ற ஐதராக்சைடு அயனிகளை வெளிவிடுகின்றன. சோடியம் ஐதராக்சைடு ஆண்டுதோறும் பலமில்லியன் டன்கள் உற்பத்தி செய்யப்படும் வேதிப்பொருள் என்ற வணிகத் தரத்தை எட்டியுள்ளது.
| |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| முறையான ஐயூபிஏசி பெயர்
ஐதராக்சைடு | |||
| இனங்காட்டிகள் | |||
| 14280-30-9 | |||
| ChEBI | CHEBI:16234 | ||
| ChemSpider | 936 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 961 | ||
| |||
| UNII | 9159UV381P | ||
| பண்புகள் | |||
| OH− | |||
| வாய்ப்பாட்டு எடை | 17.01 g·mol−1 | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
தொடர்புள்ள மின்வேதியியலின் படி நடுநிலையாக உள்ள •HO அயனி ஐதராக்சில் இயங்குறுப்பு எனப்படுகிறது. சகப் பிணைப்பால் பிணைக்கப்பட்டுள்ள –OH என்ற அயனி ஐதராக்சில் குழு எனப்படுகிறது. ஐதராக்சைடு அயனியும் ஐதராக்சில் குழுவும் மின்னணு மிகுபொருள்கள் எனப்படுகின்றன. இவை கரிம வேதியியலில் வினையூக்கிகளாகப் பயன்படுகின்றன. பல கனிம வேதியியல் சேர்மங்களுடன் ஐதராக்சைடு என்ற சொல் அவற்றின் பெயருடன் இணைந்திருக்கிறது. ஆனால் அவை ஐதராக்சைடு அயனியின் அயனிச் சேர்மங்கள் அல்ல. ஆனால் அவை ஐதராக்சில் குழுவைக் கொண்டுள்ள சகப்பிணைப்புச் சேர்மங்களாகும்.
ஐதராக்சைடு அயனி
தொகுதன் அயனியாதல் வினையின் விளைவாக ஐதராக்சைடு அயனி தண்ணீரின் ஓர் இயற்கையான பகுதிக்கூறாகும்:[1]
- H3O+ + OH− 2H2O
இவ்வினையின் சமநிலை மாறிலியை கீழ்கண்டவாறு வரையறுக்கலாம். Kw = [H+][OH−][note 1]
25 ° செல்சியசு வெப்பநிலையில் இதன் மதிப்பு 10−14 என்ற அளவுக்கு நெருக்கமாக இருக்கிறது. எனவே தூய நீரில் ஐதராக்சைடு அயனியின் அடர்த்தி 10−7 மோல்*டெசிமீட்டர்−3 என்ற அளவுக்கு நெருக்கமாக இருக்கிறது. சம அளவு மின்சுமையை கட்டுப்படுத்தும் திருப்திக்காக இந்த அடர்த்தியைப் பெறுகிறது. ஒரு கரைசலின் pH மதிப்பானது ஐதரசன் நேர்மின் அயனியின் அடர்த்தியுடன் தொடர்பு கொண்டுள்ளது[note 2]. சாதாரண வெப்பநிலையில் தண்ணீரின் pH மதிப்பு 7 ஆகும். ஐதராக்சைடு அயனியின் அடர்த்தியும் pOH மதிப்பின் மூலம் அளவிட முடியும். இது 14-pH மதிப்பாகும்[note 3]. எனவே தூய தண்ணீரின் pOH மதிப்பும் 7 என்ற மதிப்புக்கு நெருக்கமாகவே இருக்கிறது. தண்ணீருடன் காரத்தைக் கலந்தால் ஐதரசன் நேர் மின் அயனியின் அடர்த்தி குறையும். இதனால் ஐதராக்சில் அயனியின் அடர்த்தி அதிகரிக்கும். அதாவது -pH மதிப்பு அதிகரிக்கும் pOH மதிப்பு குறையும். காரத்தில் ஐதராக்சைடு அயனி இல்லாவிட்டாலும் இந்த நிகழ்வு நடக்கும். உதாரணமாக அமோனியாவின் pH மதிப்பு NH3 + H+ ⇌ NH+4 என்ற வினையின் காரணமாக 7 என்ற மதிப்பைக் காட்டிலும் அதிகமாக இருக்கிறது. இதன் விளைவாக ஐதரசம் நேர்மின் அயனியின் அடர்த்தி குறைந்து ஐதராக்சைடு அயனியின் அடர்த்தி அதிகரிக்கிறது. பல்வேறு தாங்கல் கரைசல்களில் கிட்டத்தட்ட நிலையான pOH மதிப்பைப் பராமரிக்க முடியும்.
நீரிய கரைசலில் [2] பிரான்சுடெட்டு-லோவ்ரி அமிலத்திலிருந்து ஒரு புரோட்டானை ஏற்றுக் கொள்ள முடியும் என்பதால் ஐதராக்சைடு அயனி பிரான்சுடெட்டு-லோவ்ரி நோக்கில் ஒரு காரமாகும். ஓரிணை எலக்ட்ரான்களை கொடையளிப்பதன் மூலம் இலூயிசு காரமாகவும் இதனால் செயல்பட முடியும். நீரிய கரைசலில் ஐதரசன் மற்றும் ஐதராக்சைடு இரண்டுமே ஆக்சிசன் மற்றும் ஐதரசன் அணுக்களுக்கு இடையில் ஐதரசன் பிணைப்பு மூலம் வலிமையாக கரைப்பானேற்றம் அடைகின்றன. உண்மையில் இங்கு திண்ம நிலையில் பை ஐதராக்சைடு அயனி H3O−2 அடையாளப்படுத்தப்படுகிறது.
கரைசலில் உள்ள ஐதராக்சைடு அயனி காற்றில் பட நேர்ந்தால் அது விரைவாக வளிமண்டல கார்பனீராக்சைடுடன் ஓர் அமிலமாக வினைபுரிந்து பைகார்பனேட்டு அயனியாக உருவாகிறது.
- OH− + CO2 HCO−
3
இவ்வினையின் சமநிலை மாறிலியை கரைந்துள்ள கார்பன் டை ஆக்சைடுடன் புரியும் வினை என்றோ அல்லது வளிமண்டல கார்பன் டை ஆக்சைடுடன் புரியும் வினை என்றோ குறிப்பிட்டுக் கூறலாம். நடுநிலை அல்லது அமில pH இல் வினையின் வேகம் மிகவும் குறைவு ஆகும். ஐதராக்சைடு அயனிகளைக் கொண்டுள்ள கரைசல்கள் கண்னாடியைத் தாக்குகின்றன. இங்கு கண்ணாடியில் உள்ள சிலிக்கேட்டு அமிலமாக செயற்படுகிறது. கார ஐதராக்சைடுகள் திண்மமாக இருந்தாலும் அவற்றை காற்று புகா நெகிழிப் புட்டிகளில் சேமிக்க வேண்டும்.
மேற்கோள்கள்
தொகு- ↑ Geissler, P. L.; Dellago, C.; Chandler, D.; Hutter, J.; Parrinello, M. (2001). "Autoionization in liquid water". Science 291 (5511): 2121–2124. doi:10.1126/science.1056991. பப்மெட்:11251111. Bibcode: 2001Sci...291.2121G. http://gold.cchem.berkeley.edu:8080/Pubs/DC174.pdf. பார்த்த நாள்: 2018-05-20.
- ↑ Marx, D.; Chandra, A; Tuckerman, M.E. (2010). "Aqueous Basic Solutions: Hydroxide Solvation, Structural Diffusion, and Comparison to the Hydrated Proton". Chem. Rev. 110 (4): 2174–2216. doi:10.1021/cr900233f. பப்மெட்:20170203. https://archive.org/details/sim_chemical-reviews_2010-04_110_4/page/2174.
குறிப்புகள்
தொகு- ↑ [H+] denotes the concentration of hydrogen cations and [OH−] the concentration of hydroxide ions
- ↑ Strictly speaking pH is the cologarithm of the hydrogen cation activity
- ↑ pOH signifies the minus the logarithm to base 10 of {OH−}, alternatively the logarithm of 1{OH−}
நூல் பட்டியல்
தொகு- Holleman, A.F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry. Academic press. பன்னாட்டுத் தரப்புத்தக எண் 978-0-12-352651-9.
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. பன்னாட்டுத் தரப்புத்தக எண் 978-0131755536.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- Shriver, D.F; Atkins, P.W (1999). Inorganic Chemistry (3rd ed.). Oxford: Oxford University Press. பன்னாட்டுத் தரப்புத்தக எண் 978-0-19-850330-9.
- Wells, A.F (1962). Structural Inorganic Chemistry (3rd. ed.). Oxford: Clarendon Press. பன்னாட்டுத் தரப்புத்தக எண் 978-0-19-855125-6.