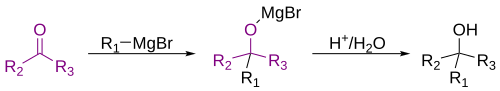
கிரின்யார்டு வினை
கிரின்யார்டு வினை அல்லது கிரின்யார்டு தாக்கம் (Grignard reaction) என்பது ஒரு கரிம உலோக வேதியியற் தாக்கம் ஆகும். இத்தாக்கத்தின் போது கிரின்யார்டு வினைபொருட்கள் அல்லது கிரின்யார்டு கரணிகள் (Grignard reagents) எனப்படும் ஆல்கைல், வினைல் அல்லது அரைல் மக்னீசியம் ஆலைடுகள் போன்றவை ஆல்டிகைடுகள் அல்லது கீட்டோன்களில் [1][2] உள்ள கார்போனைல் தொகுதியுடன் சேர்கின்றன. மேலும் இவ்வினை கரிம-கரிமப் பிணைப்பு உருவாவதற்கான ஒரு முக்கிய கருவியாக உள்ளது[3][4] கரிம ஆலைடு மக்னீசியத்துடன் புரியும் வினை கிரின்யார்டு வினை அல்ல, ஆனால் இவ்வினையினால் கிரின்யார்டு வினைப்பொருள் உருவாகிறது[5].

கிரின்யார் வினைகள் மற்றும் கிரின்யார் வினைப்பொருட்களை பிரான்சில் உள்ள நான்சி பல்கலைக்கழக வேதியியலாளர் பிரான்சுவா ஆகச்டே விக்டர் கிரின்யார் என்பவரால் கண்டுபிடிக்கப்பட்டு அவர் பெயரிலேயே அழைக்கப்பட்டது. இப்பணிக்காக[6]
அவருக்கு 1912 ஆம் ஆண்டு வேதியியலுக்கான நோபல் பரிசு வழங்கப்பட்டது. கிரின்யார் வினைப்பொருட்கள் கரிம லித்திய வினைப்பொருட்களுக்கு சமமாக வினையாற்றுகிறது. இவ்விரண்டு கரணிகளுமே கார்பன் – கார்பன் பிணைப்புகளை உருவாக்குவதில் வலிமையானவையாக உள்ளன.
வினை வழிமுறை
தொகுகிரிகனார்டு கரணி மின்னணு மிகுபொருளாக செயல்பட்டு கார்போனைல் தொகுதியின் முனைவுப் பிணைப்பில் உள்ள எலக்ட்ரான் கவர் கார்பன அணுவைத் தாக்குகிறது. கார்போனைல் தொகுதியுடனான கிரிகனார்டு கரணியின் கூட்டு காரணமாக இவ்வினை ஆறு உறுப்பு வளைய இடைநிலை மாற்றத்திற்கு செல்கிறது.[7].
கிரிகனார்டு கரணிக்கு இடையூறு ஏற்பட்டாலும் ஒற்றை எலக்ட்ரான் பரிமாற்றத்தின் வழியாக வினை தொடரலாம். இதே போன்ற வழிமுறைகளில் கார்பன் – பாசுபரசு, கார்பன் – காரீயம், கார்பன் – சிலிக்கான், கார்பன் – போரான் மற்றும் கார்பன் – பலவணு பிணைப்புகள் உருவாகிறது என கருதப்படுகிறது.
கிரின்யார்டு கரணி தயாரிப்பு முறை
தொகுகிரின்யார்டு கரணி (reagent), அல்கைல் அல்லது அரைல் ஆலைடுகள் மக்னீசியம் உலோகத்துடன் வினைபுரிவதன் வழியாக உருவாகிறது. இம்முறையில் தூய, உலர்ந்த மக்னீசியம் ஆவி மீட்புக் குளிர்கலன் பொருந்திய குடுவையில் உலர்ந்த ஈதருடன் எடுத்துக் கொள்ளப்படுகிறது. தூய, உலர்ந்த மெத்தைல் அயோடைடு குடுவைக்குள் சிறிது சிறிதாகச் சேர்க்கப்படுகிறது. வினை தொடங்கியதும் மங்கலாகத் தெரியும் ஈதரின் ஆவி பின்னர் கொதிக்க ஆரம்பிக்கிறது. குடுவையில் உள்ள கலவையை குளிரச் செய்தால் வினை முடிந்து மெத்தில் மக்னீசியம் அயோடைடின் தெளிவான கரைசல் கிடைக்கிறது. இக்கரைசலே கிரின்யார்டு கரணி எனப்படும். இக்கரணியை எல்லா வினைகளுக்கும் பயன்படுத்திக் கொள்ளலாம். உலோகத்தின் மேற்பரப்பில் வினை நடைபெறுவதாக அனுபவ ஆதாரங்கள் கூறுகின்றன. மேலும் இவ்வினையானது ஒற்றை இலத்திரன் பரிமாற்றம் வழியாக நடைபெறுகின்றது:[8][9][10]. கிரின்யார் உருவாக்க வினையில், மூலக்கூறுகள் இரண்டாவது எலக்ட்ரான் பரிமாற்றம் மூலமாக கார்பனயனாக மாற்றப்படுகிறது[11][12].
- X-+R Mg → R−X•− + Mg•+
- R−X•− → R• + X−
- R• + Mg•+ → RMg+
- RMg+ + X− → RMgX
கிரின்யார்டு கரணிகள் அல்கைல் ஆலைடுகளுடன் உடனடியாக பங்கேற்பதில்லை என வரையரை செய்யப்பட்டிருந்தாலும் மறுபுறம் அவை உடனடியாக உலோகஏற்பு வினைகளில் பங்கேற்கின்றன.
- RMgX + ArX → ArR + MgX2
இக்காரணத்திற்காக வணிக ரீதியாக கிடைக்கும் கிரின்யார்டு கரணிகள் பயன்படுத்துவது மிகவும் பயனுள்ளதாக உள்ளது. இவற்றால் வினை தொடங்குவதில் உள்ள பிரச்சினைகள் தவிர்க்கப்படுகின்றன[13].
வினைக்கான நிபந்தனைகள்
தொகுகிரின்யார் கரணி பங்கு பெறும் வினைகளில் தண்ணீர் மற்றும் காற்று முக்கியமாக தவிர்க்கப்பட வேண்டும். ஏனெனில் இவை கிரின்யார்டு கரணியை ஆக்சிசனேற்றம் செய்து அழித்துவிடும்.[14].இதனைக் கருத்திற்கொண்டேபெரும்பாலான கிரின்யார் வினைகள் நீரற்ற டை எத்தில் ஈதர் அல்லது டெட்ரா ஹைட்ரோ பியுரோன் துணையுடன் நடக்கின்றன. காற்றினால் ஏற்படுன் பக்க விளைவுகளை திரவக் கரைப்பான் அளிக்கும் பாதுகாப்புப் போர்வை கட்டுப்படுத்துகிறது. நைட்ரசன் அல்லது ஆர்கான் வாயுச் சூழலின் கீழ் காற்றில்லா தொழில்நுட்பத்தை பயன்படுத்தி சிறிய அளவிலோ அல்லது தேவைக்கேற்ப முன்னேற்பாடான தயாரிப்புகள் நடத்தப்பட வேண்டும். இதன் பின்னரும் கிரின்யார்டு கரணியில் உள்ள மக்னீசியத்தின் ஈரம் உலர்த்தப்பட கேளா ஒலி அலைகளைப் பயன்படுத்தலாம்.
மேற்கோள்கள்
தொகு- ↑ வார்ப்புரு:March6th
- ↑ http://www.mhhe.com/physsci/chemistry/carey/student/olc/ch19reactioncarboxylicacids.html
- ↑ Shirley, D. A. (1954). "The Synthesis of Ketones from Acid Halides and Organometallic Compounds of Magnesium, Zinc, and Cadmium". Org. React. 8: 28–58.
- ↑ Huryn, D. M. (1991). "Carbanions of Alkali and Alkaline Earth Cations: (ii) Selectivity of Carbonyl Addition Reactions". In Trost, B. M.; Fleming, I. (eds.). Comprehensive Organic Synthesis, Volume 1: Additions to C—X π-Bonds, Part 1. எல்செவியர். pp. 49–75. எண்ணிம ஆவணச் சுட்டி:10.1016/B978-0-08-052349-1.00002-0. பன்னாட்டுத் தரப்புத்தக எண் 978-0-08-052349-1.
- ↑ http://goldbook.iupac.org/G02699.html
- ↑ Grigdnar, V. (1900), "Sur quelques nouvelles combinaisons organométaliques du magnésium et leur application à des synthèses d'alcools et d'hydrocabures", Compt. Rend., 130: 1322–25
- ↑ Maruyama, K.; Katagiri, T. (1989), "Mechanism of the Grignard reaction", J. Phys. Org. Chem, 2 (3): 205, எண்ணிம ஆவணச் சுட்டி:10.1002/poc.610020303
- ↑ Garst, J. F.; Ungvary, F. "Mechanism of Grignard reagent formation". In Grignard Reagents; Richey, R. S., Ed.; John Wiley & Sons: New York, 2000; pp 185–275. பன்னாட்டுத் தரப்புத்தக எண் 0-471-99908-3.
- ↑ Advanced Organic chemistry Part B: Reactions and Synthesis F.A. Carey, R.J. Sundberg 2nd Ed. 1983
- ↑ எஆசு:10.1021/ja00521a034
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ de Boer, H.J.R.; Akkerman, O.S; Bickelhaupt, F. “Carbanions as intermediates in the synthesis of Grignard Reagents”, Angew. Chem. Int. Ed. 27, 687–89, 1988.
- ↑ van Klink, G.P.M.; de Boer, H.J.R; Schat, G.; Akkerman, O.S.; Bickelhaupt, F.; Spek, A. “Carbanions as Intermediates in the Formation of Grignard Reagents”, Organometallics 21, 2119–35, 2002.
- ↑ Handbook of Grignard Reagents, Silverman, G. S., Rakita, P. E., Eds.; Marcel Dekker: New York, 1996.
- ↑ Goebel, M. T.; Marvel, C. S. (1933), "The Oxidation of Grignard Reagents", Journal of the American Chemical Society, 55 (4): 1693–1696, எண்ணிம ஆவணச் சுட்டி:10.1021/ja01331a065