குரோமைல் புளோரைடு
குரோமைல் புளோரைடு (Chromyl fluoride) என்பது CrO2F2 என்ற மூலக்கூற்று வாய்ப்பாட்டைக் கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். செவ்வூதா நிறத்தில் படிகத் திண்மமாக இருக்கும் இச்சேர்மம் சூடுபடுத்தும்போது ஆரஞ்சுச்சிவப்பு நிற நீர்மமாக மாறுகிறது[2].
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
டைபுளோரோ(டையாக்சோ)குரோமியம்
| |
| வேறு பெயர்கள்
குரோமைல் புளோரைடு, குரோமியம் டைபுளோரைடு டையாக்சைடு
| |
| இனங்காட்டிகள் | |
| 7788-96-7 | |
| ChemSpider | 10329781 |
| EC number | 232-137-9 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 53471881 |
| |
| பண்புகள் | |
| CrO2F2 | |
| வாய்ப்பாட்டு எடை | 112 கி/மோல் |
| தோற்றம் | ஊதா படிகங்கள் |
| உருகுநிலை | 31.6 °C (88.9 °F; 304.8 K) |
| கொதிநிலை | 30 °C (86 °F; 303 K)[1] பதங்கமாகும் |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிகரணி |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
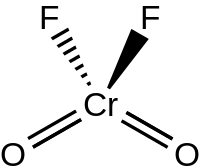
கட்டமைப்பு
தொகுகிட்டத்தட்ட குரோமைல் குளோரைடின் கட்டமைப்பை ஒத்த C2V சீர்மை கொண்ட நான்முகி வடிவ கட்டமைப்பையே நீர்ம மற்றும் வாயுநிலை குரோமைல் புளோரைடுகள் பெற்றுள்ளன. மேலும் P21/c இடக்குழுவில் Z=4 என்ற மதிப்புடன் குரோமைல் புளோரைடு படிகமாகிறது. Cr=O பிணைப்பின் பிணைப்பு நீளம் 157 பைக்கோமீட்டராகவும், Cr-F பிணைப்புகளின் பிணைப்பு நீளங்கள் 181.7, 186.7, மற்றும் 209.4பைக்கோமீட்டர்கள் எனவும் அமைகின்றன. 6 என்ற ஒருங்கிணைவு எண்ணுடன் உருக்குலைந்த எண்முக நிலையில் குரோமியம் இடம்பிடிக்கிறது. திண்மநிலையில் புளோரைடு பாலங்கள் வழியாக இது இருபடியாக்கலுக்கு உட்படுகிறது.
வினைகள்
தொகுஐதரோகார்பன்களை கீட்டோன்களாகவும் கார்பாக்சிலிக் அமிலங்களாகவும் மாற்றும் சக்தி வாய்ந்த ஆக்சிசனேற்றும் முகவராக குரோமைல் புளோரைடு வினைபுரிகிறது. மற்ற குரோமைல் சேர்மங்களை தயாரிப்பதற்கு உதவும் வினைமுகவராகவும் இது பயன்படுத்தப்படுகிறது. சில புளோரைடு சேர்மங்கள் போல, CrO2F2 கண்ணாடி மற்றும் குவார்ட்சுடன் வினைபுரிகிறது. எனவே இச்சேர்மத்தை கையாளும்போது சிலிக்கான்-அல்லாத நெகிழி அல்லது உலோக கொள்கலன்களைப் பயன்படுத்தப்பட வேண்டும்.
வரலாறு
தொகுதூய்மையான குரோமைல் புளோரைடு 1952 ஆம் ஆண்டில் முதன்முதலில் தனித்துப் பிரிக்கப்பட்டது. இங்கெல்பிரக்ட் மற்றும் குரோசீ ஆகியோர் இதைக் கண்டுபிடித்து தெரிவித்தனர் [3]. 19 ஆம் நூற்றாண்டின் ஆரம்பத்தில் புளோர்சுபார் (CaF2), குரோமேட்டுகள் மற்றும் கந்தக அமிலம் ஆகியவை அடங்கிய கலவையை வெப்பப்படுத்தும்போது தோன்றும் சிவப்பு நிற நீராவியாக இது கருதப்பட்டது. முதலில் இச்சிவப்பு நிற நீராவி CrF6 ஆக இருக்கலாம் என கருதப்பட்டது. இருப்பினும் சில வேதியியலாளர்கள் இதை CrO2F2 இன் கட்டமைப்பை ஒத்த CrO2Cl2 சேர்மம் எனக் கருதினர் [3]. குரோமைல் புளோரைடின் முதலாவது வெற்றிகரமான தயாரிப்பு முறையான தொகுப்பு வினையை பிரெடன்னாகன் கண்டறிந்து தெரிவித்தார். ஐதரசன் புளோரைடின் வினையை காரகுரோமேட்டுகளுடன் சேர்த்து ஆய்வு செய்ததாக இவர் அறிவித்தார். இதற்குப் பின்னர் வார்ட்டென்பெர்க்கு CrO2Cl2 உடன் தனிமநிலை புளோரினைச் சேர்த்து சூடுபடுத்தி தூய்மை குறைந்த குரோமைல் புளோரைடைத் தயாரித்தார். ஐதரசன் புளோரைடை டைகுரோமேட்டுடன் சேர்த்து -40 ° செல்சியசு வெப்பநிலையில் வினைபுரியச் செய்து தூய்மை குறைந்த CrO2F2 தயாரிக்கும் மற்றொரு முறையை வைய்செர்ட்டு முயற்சித்தார். குரோமியம் மூவாக்சைடுடன்(CrO3) ஒரு புளோரினேற்றும் முகவரை வினைபுரியச் செய்வது இங்கெல்பிரக்ட் மற்றும் குரோசீ ஆகியோரின் தொகுப்பு முறையில் அடிப்படையாக அமைகிறது.
- CrO3 + 2 HF → CrO2F2 + H2O
இவ்வினை ஒரு மீள்வினையாகும். CrO2F2 வை தண்ணீர் உடனடியாக நீராற்பகுப்பு செய்து மீண்டும் CrO3.ஆக மாற்றுகிறது.
குளோரின் புளோரைடு, கார்பனைல் புளோரைடு அல்லது சில உலோக எக்சாபுளோரைடுகள் உள்ளிட்ட சேர்மங்களுடன் வினைபுரியச் செய்வதை பிற தயாரிப்பு முறைகள் அடிப்படையாகக் கொண்டுள்ளன:
- CrO3 + 2 ClF → CrO2F2 + Cl2 + O2
- CrO3 + COF2 → CrO2F2 + CO2
- CrO3 + MF6 → CrO2F2 + MOF4 (M = Mo, W)
தங்குதன் புளோரைடு மற்றும் மாலிப்டினத்தைப் பயன்படுத்தி குரோமைல் புளோரைடு தயாரிக்கப்படும் கடைசி முறையை கிரீன் மற்றும் கார்டு ஆகியோர் தெரிவித்தனர். பேரளவில் தூய்மையான குரோமைல் புளோரைடைத் தயாரிக்க இம்முறை மிகவும் எளிமையானதாகவும் பயனுள்ளதாகவும் கருதப்படுகிறது[2]. 120 ° செல்சியசு வெப்பநிலையில் இவ்வினை நிகழ்த்தப்படுமெனில் 100 சதவீத உற்பத்தித் திறனை எதிர்பார்க்கலாமென இவர்கள் கூறுகின்றனர். இவ்வினையை ஒத்ததாகக் கருதப்படும் MoF6 மற்றும் WF6, சேர்மங்களின் வினையில் MoF6 சேர்மத்தின் வினை உடனடியாக நிகழ்கிறது[4].
வினைகள்
தொகுஐதரோகார்பன்களை கீட்டோன்கள் மற்றும் கார்பாக்சிலிக் அமிலங்களாக ஆக்சிசனேற்றம் செய்வதோடு மட்டும் அல்லாமல் குரோமைல் புளோரைடு கூடுதலாக பல்வேறு வகை வினைகளிலும் பங்கேற்பதாக பிரௌன், கிரீன், கார்டு ஆகியோர் தெரிவித்தனர்.[5] குரோமைல் புளோரைடால் தன்னுடைய புளோரைடு அணுக்களை உலோக ஆக்சைடுகளுடன் பரிமாறிக்கொள்ள முடியும்.
- CrO2F2 + MO → MF2 + CrO3
போரான் மற்றும் சிலிக்கன் ஆக்சைடுகளை புளொரைடுகளாகவும் குரோமைல் புளோரைடு மாற்றுகிறது. பெர்புளொரோயெப்டேன் கரைப்பானில் கரைந்த கார மற்றும் காரமண் உலோக புளோரைடுகளுடன் குரோமைல் புளோரைடு வினைபுரிந்து ஆரஞ்சு நிறத்திலான புளோரோகுரோமேட்டுகளைக் கொடுக்கிறது.
- CrO2F2 + 2 MF → M2CrO2F4
இலூயிசு அமிலங்களுடன் கூட குரோமைல் புளோரைடு வினைபுரிகிறது.:
- CrO2F2 + 2(CF3CO)2O → CrO2(CF3COO)2 + 2CF3COF
NO, NO2, மற்றும் SO2 போன்ற பலம் குறைந்த காரங்களுடன் குரோமைல் புளோரைடு வினைபுரிந்து கூட்டுசேர் பொருட்களைக் கொடுக்கிறது.
மேற்கோள்கள்
தொகு- ↑ Brauer, Georg (1963) [1960]. Handbuch Der Präparativen Anorganischen Chemie [Handbook of Preparative Inorganic Chemistry] (in German). Vol. 1. Stuttgart; New York, New York: Ferdinand Enke Verlag; Academic Press, Inc. p. 259. பன்னாட்டுத் தரப்புத்தக எண் 978-0-32316127-5. பார்க்கப்பட்ட நாள் 2014-01-12.
{{cite book}}: CS1 maint: unrecognized language (link) - ↑ 2.0 2.1 Gard, G. L. "Chromium Difluoride Dioxide (Chromyl Fluoride)" Inorganic Syntheses 1986, Volume 24, p67.
- ↑ 3.0 3.1 Engelbrecht, A., Grosse, A. V. Pure Chromyl Fluoride. J. Am. Chem. Soc. 74, 5262.
- ↑ Green, P.J., Gard, G.L., Chemistry of Chromyl Fluoride.New Preparative routes to CrO2F2. Inorg. Chem. 16, 1243. எஆசு:10.1021/ic50171a055
- ↑ Brown, S. D., Green, P.J., Gard, G.L., The Chemistry of Chromyl Fluoride, III: Reactions with Inorganic Systems. J. Fluorine Chem. 5, 203 எஆசு:10.1016/S0022-1139(00)82482-3