சல்பைடு
சல்பைடு (sulphide, Sulfide, sulfanediide அல்லது sulfide(2−)) என்பது S2−என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் எதிர்மின் அயனியாகும். கந்தகத்தின் மிக எளிய எதிர்மின் அயனியான இது, சல்பைடு உப்புகளுக்கு நிறம் எதையும் கொடுப்பதில்லை. ஒரு வலிமையான காரமாக வகைபடுத்தப்பட்டுள்ள சல்பைடு சோடியம் சல்பைடு போன்ற மிகநீர்த்த கரைசல்களிலும் அரிக்கும் தன்மையும் தோலின் மீது பட்டால் பாதிப்பையும் ஏற்படுத்துகிறது.
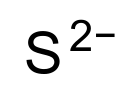
| |
| பெயர்கள் | |
|---|---|
| முறையான ஐயூபிஏசி பெயர் | |
| இனங்காட்டிகள் | |
| 18496-25-8 | |
| ChEBI | CHEBI:15138 |
| ChemSpider | 27079 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 29109 |
| |
| பண்புகள் | |
| S2− | |
| வாய்ப்பாட்டு எடை | 32.06 g·mol−1 |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | தெலூரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
பெயரிடல் வழக்கு
தொகுமுறையான பெயர்களான சல்பானிலமைடு மற்றும் சல்பைட் (2-) என்பவை ஐ.யு.பி.ஏ.சி முறையில் ஏற்றுக்கொள்ளப்பட்ட பெயர்களாகும். பதிலீட்டு பெயரிடுமுறை மற்றும் கூடுகைப் பெயரிடுமுறை போன்ற முறைகள் வழியாகவும் இப்பெயர்கள் உறுதிப்படுத்தப்படுகின்றன. எனினும், சல்பைடு என்ற பெயர் ஐ.யு.பி.ஏ.சி இன் கூட்டமைவு பெயரிடும் முறையிலும் பயன்படுத்தப்படுகிறது. இம்முறையில் பிணைப்பின் இயல்பு எடுத்துக் கொள்ளப்படுவதில்லை. செலீனியம் இருசல்பைடு மற்றும் தைட்டானியம் சல்பைடு போன்றவை இப்பெயரிடும் முறைக்கு எடுத்துக்காட்டாகும். இச்சேர்மங்களில் சல்பைடு அயனிகள் காணப்படுவதில்லை.
அமிலமாக்கல் வினையின் போது ஐதரசன் சல்பைடை வெளியிடும் சேர்மங்களை விவரிக்கவும் அல்லது இருமெத்தில் சல்பைடு போன்ற ஒரு சேர்மம் கந்தகத்தை ஏதாவது ஒரு வடிவில் சேர்த்துக் கொள்ளும் நிலையை விவரிக்கவும் சல்பைடு என்ற பெயர் பயன்படுத்தப்படுகிறது, முறையான பெயரிடல் முறை சாராத பெயருக்கு ஐதரசன் சல்பைடு என்ற பெயரும் உதாரணமாகிறது. எனினும் இச்சிறிய பெயர் சல்பேன்களைக் குறிக்கின்ற ஐ.யு.பி.ஏ.சி முறை பெயராகப் பரிந்துரைக்கப்படுகிறது.
வேதிப்பண்புகள்
தொகுஉயர்ந்த அளவு காரநீரில் கூட சல்பைடு மதிக்கத்தக்க செறிவில் காணப்படுவதில்லை. காரகாடித்தன்மை சுட்டெண் (pH) மதிப்பு <~ 15 (8 மோல் NaOH) கொண்டு கண்டறிய இயலாத நிலையில் இருக்கிறது.[2]
காரநிலை
தொகுமறுசேர்க்கை வினையின் மூலமாக ஒரு புரோட்டானை தன்வயமாக்கிக் கொள்ள சல்பைடு எதிர்மின் அயனியால் இயலும்.
- S2− + H+ → SH−
புரோட்டானை (H+) கிரகித்துக் கொள்ளும் இப்பண்பினாலேயே சல்பைடு காரத்தன்மையைப் பெறுகிறது. நீர்க்கரைசலில் சல்பைடின் காடித்தன்மை எண் மதிப்பு (pKb) சுழிக்கும் குறைவாக உள்ளது. இதனுடைய இணை அமிலம் பைசல்பைடு (SH−)ஆகும். நீர்க்கரைசலில் பெரும்பாலான சல்பைடு அயனிகள் நடுநிலையாக்கப்படுகின்றன.
- S2− + H2O SH− + OH−
வேதி வினைகள்
தொகுஅமிலங்களுடன் சேர்த்து சூடுபடுத்தும் போது சல்பைடானது ஐதரசன் சல்பைடாகவும் (H2S) ஒரு உலோக உப்பாகவும் மாற்றமடைகிறது. சல்பைடு ஆக்சிசனேற்றம் அடைந்து கந்தகம் அல்லது சல்பேட்டைக் கொடுக்கிறது. அயோடின், புரோமின், மற்றும் குளோரின் உள்ளிட்ட அலோகங்களால் கந்தகம் அல்லது உலோக உப்புகள் உருவாக்குதல் செயலால் உலோக சல்பைடுகள் அரிக்கப்படுகின்றன.
8 MgS + 8 I2 → S8 + 8 MgI2
ஒரு சல்பைடுடன் பொருத்தமான ஆக்சிகரணியைப் பயன்படுத்தி கந்தகத்தைத் தயாரிக்கலாம்.
16 HNO3 + 24 H2S → 16 NO + 3 S8 + 32 H2O
உலோக வழிப்பொருட்கள்
தொகுதாண்டல் உலோகங்களின் நேரயணி நீர்க்கரைசல்கள் சல்பைடு மூலங்களுடன் (H2S, NaHS, Na2S) வினைபுரிந்து திண்மநிலை சல்பைடுகளை வீழ்படிவாக்குகின்றன. இத்தகைய கனிம சல்பைடுகள் குறிப்பாகத் தண்ணீரில் குறைந்த கரைதிறனைக் கொண்டுள்ளன. இவற்றில் பல சேர்மங்கள் ஒரே மாதிரியான பகுதிப்பொருட்களைக் கொண்டுள்ளன. இப்பண்புடன் கூடிய சேர்மத்திற்கு முக்கிய உதாரணமாக அடர் மஞ்சள் நிற சேர்மமான (CdS) காட்மியம் மஞ்சளைக் குறிப்பிடுகிறார்கள். தூய்மையான வெள்ளியின் மீது மங்கச்செய்யும் கருமையாக உருவாவது Ag2S ஆகும். இவை சிலநேரங்களில் உப்புகளாகவும் அறியப்படுகின்றன. உண்மையில், தாண்டல் உலோக சல்பைடுகளில் சகப் பிணைப்பு காணப்படுவதால் இவை குறைக்கடத்திகளாகவும் ஆழ்நிறங்கள் கொண்டவையாகவும் விளங்குகின்றன. இவற்றில் பல சேர்மங்கள் நிறமிகளாகவும், சூரிய மின்கலங்களிலும், வினையூக்கிகளாகவும் நடைமுறை பயன்பாடுகளைக் கொண்டுள்ளன. கன உலோக சல்பைடுகளைக் கரைப்பதில் ஆசுபெர்கில்லசு நைகெர் எனப்படும் பூஞ்சை பெரும்பங்கு வகிக்கிறது.[3]
நிலவியல்
தொகுமிக முக்கியமான உலோகத் தாதுக்களாக சல்பைடுகள் காணப்படுகின்றன[4]. அர்கெண்டைட் (வெள்ளி சல்பைடு), சின்னபார் (பாதரசம்) கலீனா (ஈயச் சல்பைடு) மாலிப்டினைட்டு (மாலிப்டினம் சல்பைடு) பெண்ட்லாண்டைட்டு (நிக்கல் சல்பைடு), ரீல்கார் ( ஆர்சனிக் சல்பைடு) மற்றும் சிடிப்னைட்டு (ஆண்டிமணி) , சிபேலரைட்டு (துத்தநாக சல்பைடு) மற்றும் பைரைட்டு (இரும்பு இருசல்பைடு), சால்கோபைரைட்டு (இரும்பு – செப்பு சல்பைடு) முதலியன குறிப்பிடத்தகுந்தவையாகும்.
அரிப்பைத் தூண்டும் சல்பைடுகள்
தொகுநன்கு கரைந்துள்ள சல்பைடுகள் (H2S, HS- மற்றும் S2-) போன்றவை எஃகு, மற்றும் செம்பு போன்ற பல உலோகங்களின் அரிக்கப்படுவதற்கு மிகவும் தீவிரமான காரணிகளாக உள்ளன. நீர்க்கரைசல்களில் உள்ள சல்பைடுகள் எஃகின் அழுத்த அரிப்பு விரிசலடைதலுக்குக் காரணமாகிறது. இவ்விரிசல் சல்பைடு அழுத்த விரிசலடைதல் என்ற பெயராலும் அழைக்கப்படுகிறது. சல்பைட் தாது ஆலைகள், ஆழமான எண்ணெய் கிணறுகள், புளிப்பு எண்ணெய் கொண்டுசெல்லும் குழாய்கள், அட்டைத்தாள் தொழிற்சாலைகள் போன்ற சல்பைடுகள் தொடர்பு தொழிற்சாலைகள் நிறுவுதலில் அரிப்புச் செயல்பாடு மிகமுக்கியக் கவனத்தைப் பெறுகிறது.
நுண்ணுயிரி – தூண்டல் அரிப்பு அல்லது உயிரிவழி சல்பைடு அரிப்பு என்பவை சல்பேட்டு ஒடுக்கும் பாக்டீரியாக்களால் விளைகின்றன. இப்பாக்டீரியாக்கள் சல்பைடுகளை உற்பத்தி செய்து காற்றில் வெளிவிடுகின்றன. கந்தகத்தை ஆக்சிசனேற்றம் செய்யும் பாக்டீரியாக்கள் கந்தக அமிலத்தில் இச்சல்பைடுகளை ஆக்சிசனேற்றம் செய்கின்றன. உயிரிவழி கந்தக அமிலம் கழிவுநீர்ப் பொருட்களுடன் வினைபுரிந்து எடை இழப்பையும் இறுதியாக கழிவுநீர் குழாய்களில் உடைப்பையும் ஏற்படுத்துகின்றன. இச்சிக்கல் ஒரு உலகளாவிய சிக்கலாக பெருகி மிகுந்த பொருட்ச் செலவை ஏற்படுத்தி வருகிறது.
சல்பைடுகள் ஆக்சிசனேற்ற வினைக்கு உட்பட்டு தயோசல்பேட்டு (S2O32−) என்னும் இடைநிலைச் சேர்மமாக மாறுகின்றன. இவ்விடைநிலைச் சேர்மங்கள் கந்தக அமில உற்பத்தி மூலம் எஃகின் குழிப்பரிப்புக்கு காரணமாக இருக்கின்றன.
கரிம வேதியியல்
தொகுவழக்கமாக கரிம வேதியியலில், தயோ ஈதர் என்ற சொல் சற்று தெளிவற்றதாக இருப்பினும் சல்பைடுகள் C-S-C, என்ற தொடர்களில் அமைகின்றன. உதாரணமாக தயோ ஈதரான இருமெத்தில் சல்பைடு CH3-S-CH3 எனப்படுகிறது. பாலிபினைலீன் சல்பைடு C6H4S.என்ற முற்றுறா வாய்ப்பாட்டைக் கொண்டுள்ளது. சில சமயங்களில் சல்பைடு என்பது –SH வேதிவினை குழுவைக் கொண்டுள்ள மூலக்கூறுகளைக் குறிப்பதாக கொள்ளப்படுகிறது. உதாரணமாக மெத்தில் சல்பைடை CH3-SH என்றும் குறிக்க இயலும். அத்தகைய SH- கொண்ட சேர்மங்களை தயோல் அல்லது மெர்கேப்டன் என அழைக்கப்படுகின்றன. அதாவது மெத்தெனெத்தியோல் அல்லது மெத்தில் மெர்கேப்டன்.
இருசல்பைடுகள்
தொகுஇருசல்பைடு என்ற சொல்லின் வேறுபட்ட பொருள்களால் குழப்பங்கள் ஏற்படுகின்றன.மாலிப்டினம் இருசல்பைடில் (MoS2) ஆக்சிசனேற்ற நிலை எண் 4 கொண்ட மாலிப்டினத்துடன் (Mo4+). ஒருங்கிணைந்து தனித்தனியான சல்பைடு மையங்கள் உள்ளன. இரும்பு இருசல்பைடில் (பைரைட்டு FeS2) S22−, அல்லது −S–S− இரட்டை எதிர்மின்னயனிகள் முறையான ஆக்சிசனேற்ற எண் 2+ ஆக (பெர்ரசு அயனி: Fe2+) காணப்படுகின்றன. இருமெத்தில் இருசல்பைடின் வேதிப் பிணைப்பு CH3-S–S-CH3 ஆகும். ஆனால் கார்பன் இருசல்பைடின் பிணைப்பில் S–S பிணைப்பு இல்லை. கார்பன் டை ஆக்சைடின் நேரியல் மூலக்கூறுக்கு ஒப்புமையான S=C=S பிணைப்பு உள்ளது. பெரும்பாலும் கந்தக வேதியியல் மற்றும் உயிர்வேதியியலில், இருசல்பைடு என்ற பயன்பாடு பெராக்சைடு −O–O− பிணைப்பின் கந்தக ஒப்புமையை குறித்துக் காட்டுகிறது. புரதங்களை உறுதிப்படுத்தலிலும் நொதிகளின் வினையூக்கச் செயல்பாடுகளிலும் இருசல்பைடு பிணைப்புகள் (−S–S−) முக்கியப்பங்கு வகிக்கின்றன.
உதாரணங்கள்
தொகு| வாய்ப்பாடு | கொதிநிலை (°செ) | உருகுநிலை (°செ) | சி.ஏ.எசு எண் | |
|---|---|---|---|---|
| H2S | ஐதரசன் சல்பைடு வாயு, நச்சுத்தன்மையும் அரிக்கும் தன்மையும் கொண்ட ஒரு வாயுவாகும். அழுகிய முட்டையின் நாற்றம் இவ்வாயுவை அடையாளப்படுத்துகிறது. | -85,7 | -60,20 | 7783-06-4 |
| CdS | ஒளிமின்கலங்களில் காட்மியம் சல்பைடைப் பயன்படுத்த முடியும். | 1750 | 1306-23-6 | |
| தோட்டங்களில் பூஞ்சைக் கொல்லியாக கால்சியம் பாலிசல்பைடு பயன்படுகிறது. | ||||
| CS2 | தொழிற்சாலை வேதியியலில் கார்பன் டைசல்பைடு சிலசமயங்களில் கரைப்பானாகப் பயன்படுகிறது. | -111.6 | 46 | 75-15-0 |
| PbS | அகச்சிவப்பு உணரிகளில் ஈயச்சல்பைடு பயன்படுத்தப்படுகிறது. | 1114 | 1314-87-0 | |
| MoS2 | மாலிப்டினம் இருசல்பைடு, புதைபடிவ எரிபொருட்களில் உள்ள கந்தகத்தை நீக்க கனிமம் மாலிப்டினைட்டு வினையூக்கியாகப் பயன்படுத்தப்படுகிறது. மேலும் உயர் வெப்பநிலை மற்றும் உயர் அழுத்தப் பயன்பாடுகளில் இச்சேர்மம் உயவுப் பொருளாகவும் பயன்படுத்தப்படுகிறது. | 1317-33-5 | ||
| Cl-CH2CH2-S-CH2CH2-Cl | கந்தகக் கடுகு (கடுகுவாயு) என்பது முதல் உலக்ப் போரில் பயன்படுத்தப்பட்ட ஒரு கரிம சல்பைடு (தயோ ஈதர்) வேதியியல் ஆயுதம் ஆகும். இம்மூலக்கூறின் மீது குளோரைடு ஒரு விடுபடும் குழுவாகச் செயல்படுகிறது. தண்ணீர் முன்னிலையில் தயோ ஈதர் ஆல்ககால் மற்றும் ஐதரோ குளோரிக் அமிலமாக இது மாறுகிறது. | 13 - 14 | 217 | 505-60-2 |
| Ag2S | ஐதரசன் சல்பைடு வாயுச் சூழலில் இயங்கும் வெள்ளி மின்சுற்றுகளின் தொடர்பு கொள்ள நேர்கையில் வெள்ளி சல்பைடு உருவாகிறது. | 21548-73-2 | ||
| Na2S | சோடியம் சல்பைடு ஒரு முக்கியமான வேதிப்பொருளாகும். அட்டைத்தாள்கள், சாயங்கள், தோல் பதப்படுத்துதல் பெட்ரோலியம் பிரித்தெடுத்தல், உலோக மாசுக்கள் நீக்கம் போன்ற செயல்பாடுகளில் இச்சேர்மம் பயன்படுத்தப்படுகிறது. | 920 | 1180 | 1313-82-2 |
| ZnS | வில்லைகள், ஒளியியல் கருவிகள், நிறமாலையின் அகச்சிவப்புப் பகுதியில் பயன்படும் சில ஒளியல் கருவிகள் முதலானவற்றைத் தயாரிக்க துத்தநாக சல்பைடு பயன்படுத்தப்படுகிறது.. வெள்ளியுடன் துத்தநாக சல்பைடை கலப்பிட்டு ஆல்பா உணர்கருவிகளில் பயன்படுத்தப்படுகிறது. செப்புடன் சிறிதளவு துத்தநாக சல்பைடைச் சேர்த்து அவசர விளக்குகளில் ஒளியொளிரும் பட்டைகளில் , கடிகார முகப்புகளில் பயன்படுத்துகிறார்கள் | 1185 | 1314-98-3 | |
| MeS | பல உலோக சல்பைடுகள் கலைத்துறையில் சாயங்களாகப் பயன்படுத்தப்படுகின்றன. அதே வேளையில் சில சல்பைடுகள் அவற்றின் நச்சுத்தன்மை காரணமாக தடை செய்யவும் பட்டுள்ளன. சல்பைடு சாயங்கள் என்பவை காட்மியம் சல்பைடு, பாதரச சல்பைடு, மற்றும் ஆர்சனிக் சல்பைடு ஆகியனவற்றையும் உள்ளடக்கியதாகும். | |||
| C6H4S | பாலிபீனைலின் சல்பைட் என்பது பொதுவாக ஒரு பலபடியாகக் காணப்படுகிறது. இப்பலபடி சல்பார் எனப்படுகிறது. இதன் அடுத்தடுத்த அலகுகள் சல்பைடு அயனிகளுடன் (தயோ ஈதர்) பிணைக்கப்பட்டுள்ள இணைப்புகளாக உள்ளன. | 26125-40-6 25212-74-2 | ||
| SeS2 | செலீனியம் சல்பைடு ஒரு பூஞ்சை எதிர்ப்பியாகப் பயன்படுத்தப்படுகிறது. செல்சன் நீலம் போன்ற பொடுகு எதிர்ப்பு மருந்துகள் தயாரிப்பில் இவை பயன்படுத்தப்படுகின்றன. செலீனியம் ஓர் உயர்வகை நஞ்சு என்பதால் சுகாதார மற்றும் ஒப்பனை பொருட்களில் இதைப் பயன்படுத்துவது விரும்பத்தக்கதாக இல்லை. | <100 | 7488-56-4 | |
| FeS2 | பைரைட்டு கனிமத்தின் படிக அணிக்கோவையானது இரும்பு இருசல்பைடால் ஆக்கப்பட்டுள்ளது. இதில் இரும்பு ஈரிணைதிறன் கொண்டு பெர்ரசு அயனியாக (Fe2 +) உள்ளது.(Fe2+) | 600 | 1317-66-4 |
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 "சல்பைடு(2-) (CHEBI:15138)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute.
- ↑ Meyer, B; Ward, K; Koshlap, K; Peter, L (1983). "Second dissociation constant of hydrogen sulfide". Inorganic Chemistry 22: 2345. doi:10.1021/ic00158a027.
- ↑ Harbhajan Singh. Mycoremediation: Fungal Bioremediation. p. 509.
- ↑ Vaughan, D. J.; Craig, J. R. “Mineral chemistry of metal sulfides" Cambridge University Press, Cambridge: 1978. பன்னாட்டுத் தரப்புத்தக எண் 0-521-21489-0.