அலோகம்
இந்தக் கட்டுரையில் மேற்கோள்கள் அல்லது உசாத்துணைகள் எதுவும் இல்லை. |
அலோகம் அல்லது மாழையிலி (non-metal) என்பது வேதியியலின்படி உலோகப் பண்புகளைப் பெற்றிருக்காத வேதியியல் தனிமங்கள் ஆகும். அலோகங்கள் எளிதில் ஆவியாகக் கூடியனவாகவும், வெப்பத்தையும் மின்சாரத்தையும் எளிதில் கடத்தாத காப்புப் பொருட்களாகவும், குறைவான நெகிழ்வுத் தன்மை கொண்டவையாகவும் காணப்படுகின்றன. வேதியியல் பண்புகளின் அடிப்படையில் இவை அதிக அயனியாக்கும் ஆற்றல் மற்றும் இலத்திரன் கவர் ஆற்றல் மதிப்புகளைக் கொண்டுள்ளன. அலோகங்கள் ஏனைய தனிமங்கள் அல்லது சேர்மங்களுடன் வினைபுரியும் போது இலத்திரன்களைப் பெற அல்லது பகிர்ந்து கொள்ள முனைகின்றன.
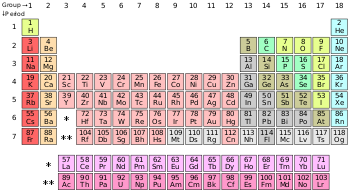
அட்டவணையில் ஐதரசன் தவிர மற்ற அலோகங்கள், p-தொகுதி யில் அடுக்கப்பட்டுள்ளன. ஹீலியம், s-தொகுதி தனிமம் பொதுவாக மந்த வாயுக்களுக்கான பண்புகளைப் பெற்றிருப்பதால் நியானுக்கு மேலாக (p-தொகுதி) வைக்கப்பட்டுள்ளது.
தனிம அட்டவணையில் சுமார் எண்பதிற்கும் மேலானவை உலோகங்கள் ஆகும். ஆனால், 17 தனிமங்களே பொதுவாக அலோகங்களாக வகைப்படுத்தப்பட்டுள்ளன. இவற்றுள் பெரும்பாலானவை வாயுக்கள். (ஐதரசன், ஈலியம், நைட்ரசன், ஆக்சிசன், புளோரின், நியான், குளோரின், ஆர்கான், கிரிப்டான், செனான் மற்றும் ரேடான்) புரோமின் மட்டும் திரவநிலையில் உள்ளது. கார்பன், பாஸ்பரஸ், கந்தகம், செலினியம் மற்றும் அயோடின் போன்ற வெகுசில அலோகங்கள் திடநிலையில் காணப்படுகின்றன.
தனிம அட்டவணையில் உள்ள ஒவ்வொரு தனிமத்தையும் இயற்பியல் வேதியியல் பண்புகளின் அடிப்படையில் ஒன்று உலோகமாகவோ அல்லது அலோகமாகவோ வகைப்படுத்த முடியும். ஒருசில தனிமங்கள் இரண்டிற்கும் இடைப்பட்ட பண்புகள் கொண்டுள்ளன. அவை மாழையனை (மாழை போன்றவை) எனப்படும்.
அலோகங்கள்
தொகு- ஐதரசன்
- நெடுங்குழு 14ல்: கரிமம்
- நெடுங்குழு 15ல்: நைதரசன், பாசுபரசு
- நெடுங்குழு 16ல் உயிர்வளிக்குழுவைச் சேர்ந்தவை: ஆக்சிசன், கந்தகம், செலீனியம்
- நெடுங்குழு 17ல் எல்லாத் தனிமங்களும் - உப்பீனிகள் (ஆலசன்கள்)
- நெடுங்குழு 18ல் எல்லாத் தனிமங்களும் - நிறைவுடை வளிமங்கள் (Noble gases)
அலோகங்களின் பண்புகள்=
தொகுஉலோகம், அலோகம் என்னும் பாகுபாட்டுக்குத் துல்லியமான வரையறைகள் ஏதும் இல்லை. அலோகங்களின் பொதுவான பண்புகள் கீழே காட்டப்பட்டுள்ளன:
- வெப்பத்தையும், மின்னாற்றலையும் அவ்வளவாகக் கடத்தா (வெப்ப, மின், வன்கடத்திகள்)
- இவை காடி ஆக்சைடுகளாகும் (ஆனால் மாழைகளோ கார ஆக்சைடுகள் ஆகும்)
- திண்மநிலையில் பளபளப்பு ஏதும் இல்லாமலும் (மங்கியதாகவும்), வளையாமல் எளிதில் உடையக்கூடியதாகவும் இருக்கும். (மாழைகள் பளபளம்மாகவும், வளைந்து கொடுக்கவும், தட்டி, கொட்டி நீட்சி பெறச் செய்ய வல்லதாகவும் இருக்கும்)
- அடர்த்திக் குறைவானது (மாழைகளைக் காட்டிலும்)
- குறைந்த உருகுநிலைகளும் கொதிநிலைகளும் கொண்டவை
- அதிக எதிர்மின்னிப்பிணைவீர்ப்பு (electronegativity) கொண்டவை.