வெப்ப இயக்கவியல்
வெப்ப இயக்கவியல் (Thermodynamics) என்பது வெப்பம், அதன் தன்மை, வெப்ப ஆற்றலுக்குப் பிற ஆற்றல் வடிவங்களுடான தொடர்பு போன்ற விடயங்களை ஆயும் இயல். இயற்பியலின் ஒரு கிளைத் துறையான இது, இயற்பியல் முறைமைகளில், வெப்பநிலை, அழுத்தம், கனவளவு ஆகியவற்றில் ஏற்படும் மாற்றங்களின் விளைவுகளை ஆய்வு செய்கிறது. மேற்படி விளைவுகளைப் பெருநோக்கு (macroscopic) அடிப்படையில் துகள்களின் மொத்த இயக்கங்களையும், புள்ளியியல் முறைகளைப் பயன்படுத்தி இது ஆய்வு செய்கின்றது. அண்ணளவாக, வெப்பம் என்பது மாறுநிலையில் உள்ள ஆற்றல் ஆகும். எனவே வெப்ப இயக்கவியலின் பிழிவானது, ஆற்றலின் இயக்கம் பற்றியும், அவ்வாற்றல் எவ்வாறு இயக்கத்தை ஏற்படுத்துகிறது என்பது பற்றியும் ஆய்வு செய்தல் ஆகும். இத்துறையை தெறுமத்தினவியல் என்றும் தமிழில் குறிப்பிடலாம் எனச் சிலர் பரிந்துரை செய்கின்றனர்.
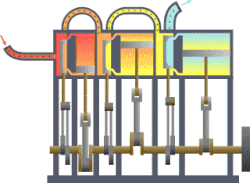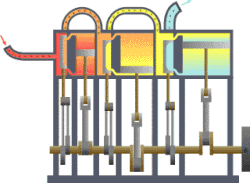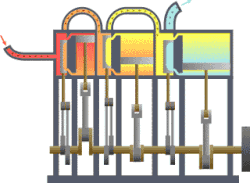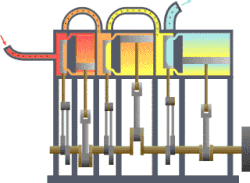
தொடக்கத்தில் இத்துறையானது நீராவி எஞ்சினின் பயனுறு திறனை (efficiency) மேம்படுத்துவதற்காகவே உருவாக்கி வளர்க்கப்பட்டது. இயந்திர வெப்ப சுழற்சிகளுக்கு வெப்ப இயக்கவியல் ஆரம்ப பயன்பாடு இரசாயன கலவைகள் மற்றும் இரசாயன எதிர்வினைகள் ஆய்வு ஆரம்பத்தில் நீட்டிக்கப்பட்டது. ரசாயன எதிர்வினைகளை செயல்படுத்துவதில் எண்டிரோபியின் பங்கின் இயல்பை வேதியியல் வெப்பமானியியல் ஆய்வு செய்கிறது.[1][2][3][4][5][6][7][8][9]
அமைப்பு
தொகுவெப்ப இயக்கவியலில் ஆய்வுக்காக எடுத்துக் கொள்ளப்பட்ட அண்டத்தின் ஒரு குறிப்பிட்ட பகுதியை அமைப்பு (system) அல்லது தொகுதி என்கிறோம். அமைப்பைச் சுற்றி இருக்கும் ஏனைய அனைத்தும் சுற்றுப்புறமாகும் (சூழல்) (surrounding). அமைப்பும் சுற்றுப்புறமும் சேர்ந்த தொகுப்புக்கு அண்டம் (Universe) என்று பெயர். அமைப்பை அதன் தன்மையைப் பொறுத்து மூன்று வகைகளாகப் பிரிக்கலாம்.
- திறந்த அமைப்பானது (open system) நிறையையும் ஆற்றலையும் தன்னுள் செல்ல அனுமதிக்கக் கூடியதாகும். உதாரணம்: காற்று அழுத்தி (compressor), சுழலி (turbine)
- மூடிய அமைப்பு (closed system) என்பது ஆற்றலை மட்டுமே அனுமதிக்கும். நிறையை அனுமதிக்காது. உதாரணம்: அழுத்த சமையற்கலன் (pressure cooker)
- தனித்த அமைப்பு (isolated system) நிறை மற்றும் ஆற்றல் இரண்டையுமே தன்னுள் செல்ல அனுமதிக்காது.
அமைப்பின் வகைகளை எளிய உதாரணங்கள் வாயிலாக விளக்கலாம். நாம் மூடப்படாத பாத்திரத்தில் சமைக்கும் போது நீராவி (steam) கலனை விட்டு வெளியேறும். வெளியேறும் நீராவி வெப்ப ஆற்றலைக் கொண்டிருக்கும். இது திறந்த அமைப்பாகும். நாம் அன்றாட வாழ்க்கையில் காணும் அமைப்புகள் திறந்த அமைப்புகள் ஆகும். அழுத்த சமையற் கலனில் உணவு சமைக்கும் போது கலனை விட்டு நீராவி வெளியேறாது. ஆனால் வெப்பம் கலனுக்குள் செல்கிறது. இது மூடிய அமைப்பைக் குறிக்கிறது. சமைத்த பின் பொருளை வெப்பக் குடுவைக்குள் (Thermo flask) வைக்கும் போது நிறை மற்றும் ஆற்றல் இரண்டுமே வெளியேறுவது இல்லை. இது தனித்தஅமைப்பு ஆகும். ஆனால், தனித்த அமைப்பானது கருத்தளவில் மட்டுமே கூறப்படுகிறது. வெப்பக் குடுவையில் சிறிதளவாயினும் வெப்பப் பெயர்ச்சி நிகழும். புரிதலை எளிதாக்குவதற்கு இந்த எடுத்துக்காட்டுகள் கொடுக்கப்பட்டு உள்ளன.
அமைப்பை அதன் சுற்றுப் புறத்தில் இருந்து பிரிப்பது எல்லை எனப்படும். எல்லை உண்மையானதாகவோ, கற்பனையாகவோ, நிலையானதாகவோ அல்லது நகரக் கூடியதாகவோ இருக்கலாம்.
நிலைமை (phase) என்றால் பொருள் முழுவதுமாக ஒரே மாதிரியான இயற்பியல் கட்டமைப்பும் வேதிக்கலவையும் கொண்டிருப்பதாகும். ஓர் அமைப்பில் ஒரே ஒரு நிலைமை மட்டும் இருந்தால் அதனை ஒருபடித்தான(homogeneous) அமைப்பு என்கிறோம். உதாரணம்: முழுவதும் கலக்கக் கூடிய திரவங்களின் கலவை, வாயுக்களின் கலவை. ஒன்றுக்கு மேற்பட்ட நிலைமைகளைக் கொண்டிருக்கும் அமைப்பை பலபடித்தான (heterogeneous) அமைப்பு எனலாம். உதாரணம்: ஒன்றுடன் ஒன்று கலக்காத திரவங்களின் கலவை, திரவம் மற்றும் வாயு சேர்ந்த தொகுப்பு
அமைப்பின் பண்புகள்
தொகுஅமைப்பின் குணாதிசயங்களை அதன் பண்புகள் (properties) என்கிறோம். அழுத்தம் (pressure), வெப்பநிலை (temperature), கன அளவு (volume), நிறை (mass), பாகுநிலை (viscosity), வெப்பக் கடத்துதிறன் (thermal conductivity), மின்கடத்துதிறன் (electrical conductivity) என்பன சில பண்புகளாகும். அமைப்பின் பண்புகளை இரு வகைகளாகப் பிரிக்கலாம்.
நிறையைச் சார்ந்திராத பண்புகள் பொருண்மை சாராப் பண்புகள் அல்லது அகப் பண்புகள் (intensive properties) எனவும், நிறை மற்றும் அளவைச் சார்ந்துள்ள பண்புகள் பொருண்மைசார் பண்புகள் அல்லது புறப் பண்புகள் (extensive properties) எனவும் அழைக்கப்படுகின்றன.
வெப்பநிலை மற்றும் அழுத்தம் முதலியவை நிறையைச் சார்ந்து மாறுவது இல்லை. இவை அகப் பண்புகளுக்கு உதாரணங்களாகும். மேலும் இவற்றை பாகங்களாகப் பிரிக்க இயலாது. நிறை மற்றும் கனஅளவு போன்றவை அமைப்பின் அளவைச் சார்ந்து இருப்பவை. இவற்றை பாகங்களாகப் பிரிக்க முடியும். இவை புறப் பண்புகள் ஆகும். ஓரலகு நிறைக்கான அல்லது ஓரலகு மோலுக்கான புறப்பண்புகள் அகப்பன்புகள் ஆகும். உதாரணமாக, நிறை மற்றும் வெப்பக் கொள்ளளவு புறப்பண்புகள் ஆகும். ஆனால், அடர்த்தி மற்றும் தன் வெப்ப ஏற்புத்திறன் (specific heat) போன்றவை அகப்பண்புகளாகும்.
வெப்ப இயக்கவியலின் பூச்சிய விதி
தொகுஒன்றுக்கொன்று வெவ்வேறான மூன்று அமைப்புகளில் மூன்றாவது அமைப்பானது முதல் மற்றும் இரண்டாவது அமைப்புகளுடன் தனித்தனியே வெப்பச் சமநிலையில் இருந்தால், முதல் மற்றும் இரணடாவது[10] அமைப்புகளும் தங்களுக்குள் வெப்பச் சமநிலையில் இருக்கும். வெப்பநிலை என்னும் கருத்து வெளிவரக் காரணமாக இருந்தது இந்த வெப்ப இயக்கவியலின் பூஜ்ய விதி ஆகும்.
வெப்ப இயக்கவியலின் சமநிலை
தொகுஓர் அமைப்பு சமநிலையில் நேரத்தைப் பொறுத்து மாறாத பண்புகளைப் பெற்று இருந்தால் அதனை வெப்ப இயக்கவியல் சமநிலையில் உள்ளது எனலாம். ஓர் அமைப்பு வெப்ப இயக்கவியல் சமநிலையில் இருப்பதற்குக் கீழ்க்கண்ட நிபந்தனைகளைப் பெற்று இருக்க வேண்டும்.
- எந்திரவியல் சமநிலை (Mechanical Equilibrium) ஓர் அமைப்பில் உள்ள அனைத்து விசைகளும் சமன் படுத்தப்பட்டு இருந்தால் அதனை எந்திரவியல் சமநிலை என்கிறோம். அதாவது அந்த அமைப்பானது மற்றோர் அமைப்புடன் எந்த வேளையிலும் ஈடுபடாது. மேலும் அதன் எல்லாப் பகுதிகளிலும் அழுத்தம் மாறாமல் இருக்கும்.
- வெப்பச் சமநிலை (Thermal Equilibrium) அமைப்பில் வெப்பப் பரிமாற்றம் நிகழவில்லை எனில் அத்தகைய சமநிலை வெப்பச் சமநிலை ஆகும். அதாவது அமைப்புக்கும் அதன் சுற்றுப் புரத்துக்கும் இடையே வெப்பநிலை வேறுபாடு இருக்காது. வெப்பநிலை வேறுபாடு இருந்தால் மட்டுமே வெப்பப் பரிமாற்றம் நிகழும்.
- வேதிச் சமநிலை (Chemical Equilibrium) அமைப்பானது எந்த ஒரு வேதிவினைக்கும் உட்படவில்லை எனின், அவ்வமைப்பு வேதிச் சமநிலையில் உள்ளது எனலாம். எந்த ஓர் அமைப்பும் மேற்கூறப்பட்ட மூன்று சமநிலைகளையும் பெற்று இருப்பின் அந்த அமைப்பு வெப்ப இயக்கவியல் சமநிலையில் உள்ளது எனலாம். ஏதேனும் ஒரு சமநிலை இல்லாதிருப்பின் அமைப்பினில் ஆற்றல் பரிமாற்றம் நிகழ வாய்ப்பு உள்ளது. எனவே இந்த அமைப்பு வெப்ப இயக்கவியல் சமநிலையில் இல்லை என்பதாகும்.
வெப்ப இயக்கவியலின் செயல்முறைகள்
தொகுஒரு சமன்படுத்தப்பட்ட நிலையில் இருந்து மற்றோர் சமன்படுத்தப்பட்ட நிலைக்கு செல்வதே வெப்ப இயக்கவியலில் செயல்முறை எனப்படுவதாகும். வெப்ப இயக்கவியலில் கீழ்க்கண்ட செயல்முறைகள் உள்ளன.
ஒரு செயல் முறையில் செய்யப்படும் வேலை = ʃP.dV
- கன அளவு மாறாச் செயல்முறையில் செயல்முறையின் தொடக்கத்தில் இருந்து முடிவு வரை கனஅளவு மாறாமல் இருக்கும். உதாரணம்: ஆட்டோ சுழற்சியில் வெப்பம் உட்செலுத்தப்படும் மற்றும் வெப்பம் வெளியேற்றப்படும் செயல்முறைகள்
- அழுத்தம் மாறாச் செயல்முறையில் செயல்முறை முழுவதும் அழுத்தம் மாறாமல் இருக்கும். உதாரணம்: டீஸல் சுழற்சியில் வெப்பம் உட்செலுத்தப்படும் செயல்முறை அழுத்தம் மாறாச் செயல்முறையாகும்.
- வெப்பநிலை மாறாச் செயல்முறை என்பது செயல்முறையின் தொடக்க மற்றும் இறுதி நிலைகளுக்கு இடையே வெப்பநிலை மாறாமல் இருப்பதாகும். அமைப்பானது சுற்றுப் புறத்துடன் வெப்பத்தைப் பரிமாற்றம் செய்து கொள்வதால் வெப்பநிலை மாறுவது இல்லை.
- வெப்ப மாறாச்செயல்முறையில் அமைப்பு சுற்றுப் புறத்துடன் வெப்பத்தைப் பரிமாற்றம் செய்து கொள்வது இல்லை. வெப்ப மாறச் செயல் முறைக்கு உதாரணம் ஆட்டோ சுழற்சியில் நடைபெறும் சுருக்கம் மற்றும் விரிவாக்கச் செயல்முறைகளாகும்.
வெப்ப இயக்கவியல் முதல் விதி
தொகுவெப்ப இயக்கவியல் முதல் விதியின்படி ஆற்றலானது ஒரு வகையிலிருந்து மற்றொரு வகையாக மாறக்கூடியது மற்றும் எந்த ஒரு செயல்முறையிலும் ஆற்றலை ஆக்கவோ அல்லது அழிக்கவோ இயலாது. வெப்ப இயக்கவியல் முதல் விதியானது ஒவ்வொரு செயல்முறையின் போதும் நிகழும் வெவ்வேறு ஆற்றல் மாற்றங்களைப் பற்றிக் கூறுகிறது. ஆனால், அத்தகைய ஆற்றல் மாற்றங்கள் பற்றி விளக்குவதில்லை. ஒரு செயல்முறை நிகழும் திசையானது தன்னிச்சையானதா அல்லது தன்னிச்சையற்றதா என்பதைப் பற்றிய கருத்தையும் வெப்ப இயக்கவியல் முதல் விதி கூறவில்லை.
வெப்ப இயக்கவியல் இரண்டாம் விதி
தொகுகெல்வின் பிளாங்க் கூற்று
தொகுஒரு முழுமையான சுற்றில் ஒரு பொருளிலிருந்து வெப்பத்தை உறிஞ்சி, அந்த அமைப்பில் எத்தகைய சிறு மாற்றத்தையும் ஏற்படுத்தாமல், முழுவதுமாக வேலையாக மாற்றக் கூடிய இயந்திரத்தை வடிவமைக்க இயலாது.[11]
கிளாசியஸ் கூற்று
தொகு- எத்தகைய வேலையும் செய்யாமல் வெப்பத்தைக் குளிர்ந்த பொருளிலிருந்து சூடான பொருளுக்கு மாற்றுவது இயலாது.
- என்ட்ரோபியை அதிகரிக்கூடிய செயல்முறையானது தன்னிச்சையானதாகும். இக்கூற்று என்ட்ரோபி கூற்று எனப்படும். என்ட்ரோபி என்பது ஒழுங்கற்ற தன்மையை குறிக்கிறது.ஒர் இயந்திரத்தின் திறன் எப்பொழுதும் 100% அடையாது.
- ஓர் இயந்திரத்தின் திறன் என்பது வெளிப்படுத்திய ஆற்றலுக்கும் உறிஞ்சப்பட்ட ஆற்றலுக்கும் உள்ள விகிதத்தின் மதிப்பாகும். எனவே 100% திறனை ஒரு பொதும் அடைய இயலாது.
என்ட்ரோபி மாற்றம்
தொகுவெப்ப இயக்கவியல் இரண்டாம் விதியால் அறிமுகப்படுத்தப்பட்ட என்ரோபி சார்பு என்பது உமிழப்படும் வெப்பத்ததிற்கும் (வ) செயல்முறையின் வெப்ப நிலைக்கும் உள்ள விகிதமாகும்.
'இயற்கைச் செயல்முறை' என்பது தன்னிச்சைச் செயல்முறையாகும் இவை தாமாகவே நடைபெறுகின்றன. அண்டத்தின் என்ட்ரோபி மாற்றமானது பூச்சியமாகவோ அல்லது எதிர்க்குறியையோ பெற்றிருக்கும் போது, அமைப்பானது தன்னிச்சையற்ற செயல்முறையில் இயங்கும்.
ஒரு வேதிவினையில், வினைவிளை பொருள்களின் மூலக்கூறுகளின் எண்ணிக்கையானது வினைபடு பொருள்களின் மூலக்கூறுகளின் எண்ணிக்கையை விட அதிகமாக இருக்கும் போது என்ட்ரோபி அதிகரிக்கிறது.
ஒரு திண்மம் நீர்மமாதல், ஒரு நீர்மம் ஆவியாதல் மற்றும் ஒரு திண்மம் ஆவியாதல் ஆகிய நிலைமை மாற்ற இயற்பியல் செயல்முறைகளின் போது என்ட்ரோபி அதிகரிக்கிறது.
என்ட்ரோபி என்பது ஓர் அமைப்பில் நிகழும் நுண்ணிய ஒழுங்கற்ற தன்மையையும், தன்னிச்சைச் செயல்முறையையும் குறிக்கிறது.
டிரவுட்டன் விதி
தொகு- ஹைட்ரஜன் மற்றும் ஹீலியம் போன்ற குறைந்த கொதிநிலை கொண்ட நீர்மங்கள், இவற்றின் கொதிநிலை 0மு-ஐ விட மிகச் சிறிதளவே உயர்ந்திருக்கும்.
- நீர் மற்றும் ஆல்கஹால் போன்ற முனைவுற்ற சேர்மங்கள் ஹைட்ரஜன் பிணைப்பை கொண்டிருப்பதால் அதிகபட்ச ஆவியாதல் மதிப்பையும் பெற்றுள்ளன.
எண்ட்ரோப்பியின் சிறப்பியல்புகள்
தொகு- எண்ட்ரோப்பி ஆனது வெப்ப இயக்கவியல் இரண்டாம் விதியிலிருந்து வெப்ப இயக்கவியல் நிலைச்சார்பாக வருவிக்கப்பட்டுள்ளது.
- ஒரு குறிப்பிட்ட செயல்முறையில் நிகழும் அமைப்பின் எண்ட்ரோப்பி மாற்றம் என்பது மாறாத வெப்பநிலையில் நிகழும் வெப்ப மாற்றத்திற்கும் அமைப்பின் வெப்பநிலைக்கும் இடையேயான விகிதமாகும்.
- ஒரு தன்னிச்சை செயல்முறையின் போது ஒழுங்கற்ற தன்மை அல்லது எண்ட்ரோப்பி அதிகரிக்கிறது. எனவே எண்ட்ரோப்பியானது ஒரு அமைப்பின் ஒழுங்கற்ற தன்மை அல்லது மூலக்கூறுகளின் ஒழுங்கற்ற அமைப்பு ஆகியவற்றை அளவிடும் பண்பாகும். ஒரு மீளா செயல்முறையின்போது அண்டத்தின் எண்ட்ரோப்பி அதிகரிக்கிறது.
- அண்டத்தின் ஆற்றல் மாறாமல் இருந்தாலும், அண்டத்தின் எண்ட்ரோப்பி அதிகப்பட்ச அளவை நோக்கி உயர்ந்து கொண்டே இருக்கிறது.
- ஒரு தன்னிச்சைச் செயல்முறையில் மாறாத வெப்பநிலையில், நேர்க்குறியைப் பெற்றுள்ளது (ள,0).
ஒரு சமநிலை செயல்முறையில் ஆனது பூஜ்ஜியமாகும். ஒரு தன்னிச்சையற்ற செயல்முறையில் எதிர்க்குறியைப் பெற்றுள்ளது.
இவற்றையும் பார்க்கவும்
தொகுமேற்கோள்கள்
தொகு- ↑ Gibbs, Willard, J. (1876). Transactions of the Connecticut Academy, III, pp. 108-248, Oct. 1875-May 1876, and pp. 343-524, May 1877-July 1878.
- ↑ Duhem, P.M.M. (1886). Le Potential Thermodynamique et ses Applications, Hermann, Paris.
- ↑ Lewis, Gilbert N.; Randall, Merle (1923). Thermodynamics and the Free Energy of Chemical Substances. McGraw-Hill Book Co. Inc.
- ↑ Guggenheim, E.A. (1933). Modern Thermodynamics by the Methods of J.W. Gibbs, Methuen, London.
- ↑ Guggenheim, E.A. (1949/1967). Thermodynamics. An Advanced Treatment for Chemists and Physicists, 1st edition 1949, 5th edition 1967, North-Holland, Amsterdam.
- ↑ Ilya Prigogine, I. & Defay, R., translated by D.H. Everett (1954). Chemical Thermodynamics. Longmans, Green & Co., London. Includes classical non-equilibrium thermodynamics.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Enrico Fermi (1956). Thermodynamics. Courier Dover Publications. pp. (ix). பன்னாட்டுத் தரப்புத்தக எண் 048660361X. இணையக் கணினி நூலக மைய எண் 230763036.
- ↑ Perrot, Pierre (1998). A to Z of Thermodynamics. Oxford University Press. பன்னாட்டுத் தரப்புத்தக எண் 0-19-856552-6. இணையக் கணினி நூலக மைய எண் 123283342.
- ↑ Clark, John, O.E. (2004). The Essential Dictionary of Science. Barnes & Noble Books. பன்னாட்டுத் தரப்புத்தக எண் 0-7607-4616-8. இணையக் கணினி நூலக மைய எண் 58732844.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Moran, Michael J. and Howard N. Shapiro, 2008. Fundamentals of Engineering Thermodynamics. 6th ed. Wiley and Sons: 16.
- ↑ Clausius, R. (1850). Ueber de bewegende Kraft der Wärme und die Gesetze, welche sich daraus für de Wärmelehre selbst ableiten lassen, Annalen der Physik und Chemie, 155 (3): 368–394.