தைட்டானியம்(IV) புளோரைடு
தைட்டானியம்(IV) புளோரைடு (Titanium(IV) fluoride) என்பது TiF4 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். தைட்டானியம் மற்றும் புளோரின் தனிமங்கள் இணைந்து இச்சேர்மம் உருவாகிறது. வெண்மை நிறத்தில் காணப்படும் இத்திண்மம் ஒரு நீருறிஞ்சியாகும். பிற டெட்ரா ஆலைடுகளிலிருந்து மாறுபட்டு தைட்டானியம்(IV) புளோரைடு பல்பகுதிக் கட்டமைப்பை ஏற்கிறது[1]. ஆனால் பிற டெட்ரா அலைகளுடன் ஒன்றுபட்டு ஒரு லூயிசு அமிலமாக தைட்டானியம்(IV) புளோரைடு செயல்படுகிறது.
| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
தைட்டானியம் டெட்ராபுளோரைடு
| |
| இனங்காட்டிகள் | |
| 7783-63-3 | |
| ChemSpider | 7988529 |
| EC number | 232-017-6 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 121824 |
| |
| பண்புகள் | |
| TiF4 | |
| வாய்ப்பாட்டு எடை | 123.861 கி/மோல் |
| தோற்றம் | வெண் தூள் நீருறிஞ்சும் |
| அடர்த்தி | 2.798 கி/செ.மீ3 |
| உருகுநிலை | 377 °C (711 °F; 650 K) |
| கொதிநிலை | பதங்கமாகும் |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | இல்லை |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகுபாரம்பரிய தயாரிப்பு முறையில் தைட்டானியம் டெட்ராகுளோரைடுடன் மிகையளவு ஐதரசன் புளோரைடைச் சேர்த்து வினைபுரியச் செய்வதால் தைட்டானியம்(IV) புளோரைடு உருவாகிறது.
- TiCl4 + 4 HF → TiF4 + 4 HCl
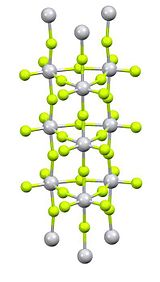
பதங்கமாதல் முறையில் இச்சேர்மம் தூய்மையாக்கப்படுகிறது. பல்பகுதிக் கட்டமைப்பை தலைகீழ் விரிசலாக்கும் செயல்முறை இத்தூய்மையாக்கலில் இடம்பெறுகிறது [2]. தைட்டானியம் மையங்கள் எண்முகத் தோற்றம் கொண்டிருப்பதாக எக்சுகதிர் படிகவியல் ஆய்வுகள் தெரிவிக்கின்றன. ஆனால் வழக்கத்திற்கு மாறான நிரல் அமைப்பு முறையில் இவை இணைந்துள்ளன [3]. TiF4 பல ஈந்தனைவிகளுடன் சேர்ந்து கூட்டு விளைபொருள்களைக் கொடுக்கிறது. forms adducts with many ligands. One example is சிசு-TiF4(MeCN)2 ஓர் உதாரணமாகும். அசிட்டோநைட்ரைலுடன் சேர்த்து வினைபுரியச் செய்வதால் இது தோன்றுகிறது [4].
மேற்கோள்கள்
தொகு- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 200.
- ↑ Bialowons, H.; Mueller, M.; Mueller, B.G. (1995). "Titantetrafluorid - Eine Überraschend einfache Kolumnarstruktur". Zeitschrift für Anorganische und Allgemeine Chemie 621: 1227–1231. doi:10.1002/zaac.19956210720.
- ↑ Nikiforov, Grigory B.; Roesky, Herbert W.; Koley, Debasis (2014). "A survey of titanium fluoride complexes, their preparation, reactivity, and applications". Coordination Chemistry Reviews 258-259: 16–57. doi:10.1016/j.ccr.2013.09.002.