வெள்ளீயம்(IV) அசிட்டேட்டு
வெள்ளீயம்(IV) அசிட்டேட்டு (Tin(IV) acetate) Sn(CH3COO)4 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். வெள்ளீயத்தின் அசிட்டேட்டு உப்பாக இச்சேர்மம் கருதப்படுகிறது.
 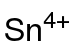
| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
வெள்ளீயம்(IV) அசிட்டேட்டு
வெள்ளீயம் டெட்ரா அசிட்டேட்டு | |
| இனங்காட்டிகள் | |
| 2800-96-6 | |
| ChemSpider | 8039142 |
| EC number | 628-765-1 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 9863446 |
| |
| பண்புகள் | |
| Sn(CH3COO)4 | |
| வாய்ப்பாட்டு எடை | 353.89 |
| தோற்றம் | வெண்மையான ஊசிகள்[1] |
| உருகுநிலை | 242 °C (468 °F; 515 K) |
| தீங்குகள் | |
| GHS pictograms | 
|
| GHS signal word | எச்சரிக்கை |
| H302, H312, H332 | |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | வெள்ளீயம்(IV) புளோரோ அசிட்டேட்டு |
| ஏனைய நேர் மின்அயனிகள் | காரீயம்(IV) அசிட்டேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகுஅசிட்டிக் நீரிலியில் உள்ள தாலியம் அசிடேட்டுடன் வெள்ளீயம்(IV) அயோடைடு சேர்த்து வினைபுரியச் செய்தால் எதிர்ப்பாய்வு வினை மூலம் வெள்ளீயம் (IV) அசிடேட்டு உருவாகிறது. வினை முடிந்ததும், கரைசல் செறிவூட்டப்பட்டும் குளிரூட்டப்பட்டும் படிகங்களைத் துரிதப்படுத்துகிறது, அவை நீரற்ற ஈதரால் கழுவப்பட்டு விளைபொருள் வெற்றிடத்தில் உலர்த்தப்படுகிறது:[1]
- 4 CH3COOTl + SnI4 → Sn(CH3COO)4 + 4 TlI↓
அசிட்டிக் அமிலம்-அசிட்டிக் நீரிலி கலவையில் உள்ள டெட்ராபீனைல்வெள்ளீயம் 120 பாகை செல்சியசு வெப்பநிலையில் எதிர்ப்பாய்மம் அடைந்து அளவு அடிப்படையில் உருவாகிறது::[3]
- 4 CH3COOH + (C6H5)4Sn → Sn(CH3COO)4 + 4C6H6
அசிட்டிக் அமிலம் மற்றும் அசிட்டிக் நீரிலியுடன் வெள்ளீயம்(IV) நைட்ரேட்டு வினைபுரிவதாலும் வெள்ளீயம்(IV) அசிடேட்டை உருவாக்கலாம். ஆனால் டிரைபுளோரோ அசிட்டிக் நீரிலியுடனான வினை அதனை ஒத்த விளைபொருளைத் தருவதில்லை. மாறாக (NO2)2[Sn(CF3COO)6] உருவாகிறது.
- 4 CH3COOH + Sn(NO3)4 → Sn(CH3COO)4 + 4 HNO3
இயற்பியல் பண்புகள்
தொகுவெள்ளீயம்(IV) அசிட்டேட்டு தண்ணீருடன் வினைபுரியும் போது சிதைவடைகிறது. வெள்ளீயம் ஐதராக்சைடும் அசிட்டிக் அமிலமும் உருவாகின்றன.:[1]
- Sn(CH3COO)4 + 4 H2O → Sn(OH)4 + 4 CH3COOH
தயோல் போன்ற கந்தகம் கலந்துள்ள சேர்மங்களுடன் இது வினைபுரிந்து அதே போல கந்தகம் கலந்துள்ள வெள்ளீய சேர்மங்களைக் கொடுக்கிறது.[4]
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 1.2 Tin(IV) acetate
- ↑ "Tin(IV) acetate". pubchem.ncbi.nlm.nih.gov (in ஆங்கிலம்).
- ↑ Sawyer, Albert K.; Frey, Craig (January 1983). "A Simple Synthesis of Tin(IV) Acetate from Tetraphenyltin" (in en). Synthesis and Reactivity in Inorganic and Metal-Organic Chemistry 13 (2): 259–262. doi:10.1080/00945718308059330. பன்னாட்டுத் தர தொடர் எண்:0094-5714. http://www.tandfonline.com/doi/abs/10.1080/00945718308059330.
- ↑ Mehrotra, R.C.; Srivastava, G.; Vasanta, E.N. (January 1981). "Reactions of tin tetraacetate with sulphur ligands" (in en). Inorganica Chimica Acta 47: 125–130. doi:10.1016/S0020-1693(00)89317-2. https://linkinghub.elsevier.com/retrieve/pii/S0020169300893172.
மேலும் படிக்க
தொகு- Sakuntala, E. N.; Shanker, Rama (May 1986). "Reactions of tin tetraacetate with benzothiazolines" (in en). Monatshefte für Chemie Chemical Monthly 117 (5): 607–612. doi:10.1007/BF00817897. பன்னாட்டுத் தர தொடர் எண்:0026-9247. http://link.springer.com/10.1007/BF00817897.