காலியம்(III) டிரையாக்சைடு
காலியம்(III) டிரையாக்சைடு (Gallium(III) trioxide) என்பது Ga2O3 என்ற மூலக்கூற்று வாய்ப்பாடு மூலக்கூறு வாய்ப்பாடு கொண்ட ஒரு கனிமச் சேர்மமாகும். . இது பல பல்லுருவ அமைப்புகளில் காணப்படுகிறது. இவை அனைத்தும் வெள்ளை நிறமாகவும் நீரில் கரையாத திடப்பொருள்களாகவும் உள்ளன. வணிக பயன்பாடுகள் எதுவும் இல்லை என்றாலும், Ga2O3 என்பது காலியத்தை சுத்திகரிப்பதில் உருவாகும் ஓர் இடைநிலை விளைபொருளாகும். கிட்டத்தட்ட இது பிரத்தியேகமாக காலியம் ஆர்சனைடு என நுகரப்படுகிறது[6].
 β-Ga2O3 படிகம்
| |
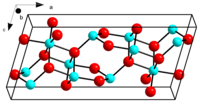 β-Ga2O3கட்டமைப்பு
| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
காலியம் டிரையாக்சைடு, காலியம் செசுகியுவாக்சைடு
| |
| இனங்காட்டிகள் | |
| 12024-21-4 | |
| ChemSpider | 139522 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 5139834 |
| வே.ந.வி.ப எண் | LW9650000 |
| |
| பண்புகள் | |
| Ga2O3 | |
| வாய்ப்பாட்டு எடை | 187.444 கி/மோல்[1] |
| தோற்றம் | வெண் படிகத் தூள் |
| அடர்த்தி | 6.44 கி/செ.மீ3, ஆல்பா 5.88 கி/செ.மீ3, பீட்டா |
| உருகுநிலை | 1,900 °C (3,450 °F; 2,170 K) ஆல்பா 1725 °செ, பீட்டா [2] |
| கரையாது | |
| கரைதிறன் | அமிலங்களில் கரையும் |
| கட்டமைப்பு | |
| படிக அமைப்பு | α: முக்கோணம், hR30, இடக்குழு = R3c, No. 167[3] |
| Lattice constant | a = 0.49835 / 1.22247 நானோமீட்டர், b = 0.49835 / 0.30403 நானோமீட்டர், c = 0.53286 / 0.58088 நானோமீட்டர் |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−1089.1 கிலோயூல்/மோல்[5] |
| நியம மோலார் எந்திரோப்பி S |
85.0 யூல்/மோல்•கெல்வின்[5] |
| வெப்பக் கொண்மை, C | 92.1 யூல்/மோல்.கெல்வின்[5] |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | பட்டியலிடப்படவில்லை |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகுகாலியம் உப்பின் அமிலம் அல்லது காரக் கரைசலை நடுநிலையாக்குவதன் மூலம் காலியம் டிரையாக்சைடு நீரேற்ற வடிவத்தில் வீழ்படிவாக்கப்படுகிறது. மேலும், இது காற்றில் காலியத்தை சூடாக்குவதன் மூலம் உருவாகிறது அல்லது காலியம் நைட்ரேட்டை 200-250 பாகை செல்சியசு வெப்பநிலைக்கு சூடாக்கி சிதைப்பதன் மூலம் உருவாகிறது. இது ஐந்து வெவ்வேறு வகையான α, β, γ, δ, மற்றும் ε என்ற மாறுபட்ட உருவங்களாக தோன்றுகிறது. இந்த மாற்றங்களில் β-Ga 2 O 3 மிகவும் நிலையான வடிவமாகும்[7].
•நைட்ரேட்டு, அசிடேட்டு, ஆக்சலேட்டு அல்லது பிற கரிம வழிப்பெறுதிகளை 1000 பாகை செல்சியசுக்கு மேல் வெப்பப்படுத்துவதன் மூலம் β-Ga 2 O 3 தயாரிக்கப்படுகிறது.
•β-Ga2O3 சேர்மத்தை 65 கிலோபார் அழுத்தம் மற்றும் 1100 பாகை செல்சியசு வெப்பநிலைக்கு வெப்பப்படுத்துவதன் மூலம் α-Ga2O3 சேர்மத்தை பெறலாம். நீரேற்ற வடிவ α-Ga2O3 சேர்மத்தை vஈழ்படிவாக்கப்பட்ட நாள்பட்ட காலியம் ஐதராக்சைடை 500 பாகை செல்சியசு வெப்பநிலைக்கு சூடுபடுத்தி சிதைவுக்கு உள்ளாக்கி தயாரிக்கலாம்.
•γ-Ga2O3 சேர்மத்தை ஐதராக்சைடு அரைதிண்மக் கரைசலை 400–500 °செல்சியசு வெப்பநிலைக்கு சூடுபடுத்தி தயாரிக்கலாம். இந்த பல்லுருவ வடிவத்தை காலியம் உலோகத்திலிருந்து நேரடியாக கரைசல் தொகுப்புமுறை மூலம் தயாரிக்கலாம்[8].
•δ-Ga2O3 சேர்மத்தை Ga (NO 3 ) 3 சேர்மத்தை 250 பாகை செல்சியசு வெப்பநிலைக்கு வெப்பப்படுத்துவதன் மூலம் பெறப்படுகிறது
•550 பாகை செல்சியசு வெப்பநிலைக்கு δ-Ga2O3 சேர்மத்தை சூடாக்குவதன் மூலம் ε-Ga2O3 சேர்மம் தயார் செய்யப்படுகிறது. ε-Ga2O3 சேர்மத்தின் மெல்லிய ஏடுகள் 550 பாகை செல்சியசு வெப்பநிலையில் டிரைமெத்தில்காலியத்தைப் பயன்படுத்தி உலோகக் கரிம ஆவிநிலை மென்படலமாக்கல் முறையையில் படியவைக்கப்படுகிறது[9].
வினைகள்
தொகுகாலியம்(III) டிரையாக்சைடு ஓர் ஈரியல்புநிலை ஆக்சைடு ஆகும். இது உயர் வெப்பநிலையில் NaGaO2 மற்றும் Mg, Zn, Co, Ni, Cu போன்ற கார உலோக ஆக்சைடுகளுடன் வினைபுரிந்து சிபினல்களை உருவாக்குகிறது[10], எ.கா. MgGa 2 O 4 . இது வலிமையான காரத்தில் கரைந்து காலேட்டு அயனியின் Ga(OH)−4 கரைசலாக உருவாகிறது. HCl உடன், இது காலியம் டிரைக்ளோரைடு GaCl 3 சேர்மத்தை உருவாக்குகிறது. Ga2O3 + 6 HCl → 2 GaCl3 + 3 H2O இதை காலியம்(I) ஆக்சைடாக (Ga 2 O) ஐதரசன் வாயுவைப் பயன்படுத்தி குறைக்கலாம் அல்லது காலியம் உலோகத்துடன் வினைபுரியச் செய்தும் இவ்வினையை நிகழ்த்தலாம். Ga2O3 + 2 H2 → Ga2O + 2 H2O Ga2O3 + 4 Ga → 3 Ga2O
கட்டமைப்பு
தொகு1900 ˚செல்சியசு வெப்ப நிலையை உருகுநிலையாகக் கொண்ட β-Ga2O3 சேர்மம் மிகவும் நிலைப்புத்தன்மை கொண்ட படிகம் ஆகும். ஆக்சைடு அயனிகள் உருக்குலைந்த கனசதுர நெருக்கப்பொதிவு அமைப்பில் உள்ளன. காலியம்(III) அயனிகள் சிதைந்த நான்முகியிலும் எண்கோணத்திலும் தளங்களை ஆக்கிரமித்துள்ளன, கட்டமைப்பிலுள்ள Ga-O பிணைப்பு இடைவெளிகள் முறையே 1.83 மற்றும் 2.00.Å ஆகும்[11]. α-Ga 2 O 3 ஆனது -Al 2 O 3 சேர்மத்தின் அதே குருந்தம் கட்டமைப்பை கொண்டுள்ளது. இதில் Ga அயனிகள் 6-ஒருங்கிணைப்பில் உள்ளன. மேலும் γ-Ga2O3 குறைபாடுள்ள சிபினல் அமைப்பைக் கொண்டுள்ளது[12].
கரிம உலோக நீராவி நிலை மென்படலம் மூலம் படியவைக்கப்பட்ட ε-Ga2O3 செஞ்சாய்சதுர படிக சமச்சீருடன் ஒரு நிரல் படிக அமைப்பைக் காட்டுகின்றன. எக்சுகதிர் படிகவியல் ஆய்வில் இக்கட்டமைப்பு ஓர் அறுகோண நெருக்கப் பொதிவு நிரம்பியதாகக் காணமுடிகிறது[13].
பயன்பாடுகள்
தொகுசீரொளிகள் , பாசுபர்கள் மற்றும் ஒளிரும் பொருட்களின்[7] பயன்பாட்டில் காலியம்(III) ஆக்சைடு ஆய்வு செய்யப்பட்டுள்ளது. இறுக்கமான சந்திப்புகளில் இது ஒரு காப்பீட்டுத் தடையாக பயன்படுத்தப்படுகிறது[14]. ஒற்றைச்சாய்வு β-Ga 2 O 3 வாயு உணரிகள் மற்றும் ஒளிரும் பாசுபர்களில் பயன்படுத்தப்படுகிறது மற்றும் சூரிய மின்கலங்களுக்கான மின்கடத்தா பூச்சுகளுக்கு இதை பயன்படுத்தலாம். இந்த நிலையான ஆக்சைடு ஆழமான புற ஊதா வெளிப்படையான கடத்தும் ஆக்சைடுகள்[15] மற்றும் வானொலிப்பெட்டி போன்ற மின்மப் பொறிகளில் பயன்பாடுகளுக்கான சாத்தியத்தையும் இது காட்டியுள்ளது[16][17].
மெல்லிய Ga2O படலங்கள் வணிக ரீதியாக கவனத்தை ஈர்க்கின்றன[18]. β-Ga2O3 சேர்மத்தின் தளவிளைவு ஒளியியல் செயல்பாடுகளைத் தீர்மானிக்கவும் இது பயன்படுகிறது[15] Ga2O3-Al2O3 கலப்புலோக உற்பத்தியில் β-Ga2O3 ஒரு வினையூக்கியாகப் பயன்படுத்தப்படுகிறது[19].
மேற்கோள்கள்
தொகு- ↑ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.64. பன்னாட்டுத் தரப்புத்தக எண் 1439855110.
- ↑ Patnaik, Pradyot (2002) Handbook of Inorganic Chemicals. McGraw-Hill. பன்னாட்டுத் தரப்புத்தக எண் 0-07-049439-8
- ↑ Eckert, L. J.; Bradt, R. C. (1973). "Thermal Expansion of Alpha Ga2O3". Journal of the American Ceramic Society 56 (4): 229. doi:10.1111/j.1151-2916.1973.tb12471.x.
- ↑ Dohy, D.; Gavarri, J.R. (1983). "Oxyde β-Ga2O3: Champ de force, dilatation thermique, et rigidité anisotropes". Journal of Solid State Chemistry 49 (1): 107–117. doi:10.1016/0022-4596(83)90222-0. Bibcode: 1983JSSCh..49..107D.
- ↑ 5.0 5.1 5.2 Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 5.12. பன்னாட்டுத் தரப்புத்தக எண் 1439855110.
- ↑ Greber, J. F. (2012) "Gallium and Gallium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, எஆசு:10.1002/14356007.a12_163.
- ↑ 7.0 7.1 Bailar, J; Emeléus, H; Nyholm, R; Trotman-Dickenson, A. F. (1973). Comprehensive Inorganic Chemistry. Vol. 1, p. 1091
- ↑ Playford, Helen Y.; Hannon, Alex C.; Barney, Emma R.; Walton, Richard I. (2013). "Structures of Uncharacterised Polymorphs of Gallium triOxide from Total Neutron Diffraction". Chemistry – A European Journal 19 (8): 2803–13. doi:10.1002/chem.201203359. பப்மெட்:23307528.
- ↑ Boschi, F.; Bosi, M.; Berzina, T.; Buffagni, E.; Ferrari, C.; Fornari, R. (2015). "Hetero-epitaxy of ε-Ga2O3 layers by MOCVD and ALD". Journal of Crystal Growth 44: 25–30. doi:10.1016/j.jcrysgro.2016.03.013.
- ↑ Downs, Anthony John (ed.) (1993) The Chemistry of Aluminium, Gallium, Indium and Thallium. Springer . பன்னாட்டுத் தரப்புத்தக எண் 075140103X
- ↑ King, R. B. (1994) Encyclopedia of Inorganic Chemistry. Vol. 3. p. 1256. பன்னாட்டுத் தரப்புத்தக எண் 978-0-470-86078-6.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 247. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ Cora, I (2017). "The real structure of ε-Ga2O3 and its relation to κ-phase". CrystEngComm 11 (11): 1509–1516. doi:10.1039/C7CE00123A.
- ↑ Dai, Z. R.; Pan, Z. W.; Wang, Z. L. (2002). "Gallium Oxide Nanoribbons and Nanosheets". The Journal of Physical Chemistry B 106 (5): 902. doi:10.1021/jp013228x.
- ↑ 15.0 15.1 Rebien, M; Henrion, W; Hong, M; Mannaerts, J; Fleischer, M (2002). "Optical properties of gallium oxide thin films". Applied Physics Letters 81 (2): 250. doi:10.1063/1.1491613. Bibcode: 2002ApPhL..81..250R.
- ↑ Thomas, Stuart R.; Adamopoulos, George; Lin, Yen-Hung; Faber, Hendrik; Sygellou, Labrini; Stratakis, Emmanuel; Pliatsikas, Nikos; Patsalas, Panos A. et al. (2014). "High electron mobility thin-film transistors based on Ga2O3 grown by atmospheric ultrasonic spray pyrolysis at low temperatures". Applied Physics Letters 105 (9): 092105. doi:10.1063/1.4894643. Bibcode: 2014ApPhL.105i2105T.
- ↑ Higashiwaki, M.; Jessen, G. H. (2018). "The dawn of gallium oxide microelectronics". Applied Physics Letters 112 (6): 060401. doi:10.1063/1.5017845.
- ↑ Pavesi, M. (2018). "ε-Ga2O3 epilayers as a material for solar-blind UV photodetectors". Materials Chemistry and Physics 205: 502–507. doi:10.1016/j.matchemphys.2017.11.023.
- ↑ Shimizu, Ken-Ichi; Takamatsu, Mikio; Nishi, Koji; Yoshida, Hisao; Satsuma, Atsushi; Tanaka, Tsunehiro; Yoshida, Satohiro; Hattori, Tadashi (1999). "Alumina-Supported Gallium trixide Catalysts for NO Selective Reduction: Influence of the Local Structure of Surface Gallium trioxide Species on the Catalytic Activity". The Journal of Physical Chemistry B 103 (9): 1542. doi:10.1021/jp983790w.