கியூரியம்(IV) ஆக்சைடு
வேதிச் சேர்மம்
கியூரியம்(IV) ஆக்சைடு (Curium(IV) oxide) CmO2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் குறிக்கப்படும் கனிம வேதியியல் சேர்மமாகும். கியூரியம் மற்றும் ஆக்சிசன் தனிமங்கள் சேர்ந்து இச்சேர்மம் உருவாகிறது. கியூரியத்தின் அனைத்து ஓரிடத்தான்களும் மனிதனால் உருவாக்கப்பட்டவை என்பதால் இயற்கையில் கியூரியம்(IV) ஆக்சைடு தோன்றுவதில்லை.
| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
கியூரியம் ஈராக்சைடு
| |
| இனங்காட்டிகள் | |
| 12016-67-0 | |
| ChemSpider | 34998496 |
| EC number | 234-612-6 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 118856359 (charge error) |
| |
| பண்புகள் | |
| CmO2 | |
| வாய்ப்பாட்டு எடை | 279.00 g·mol−1 |
| தோற்றம் | கருப்பு படிகங்கள் |
| கரையாது | |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய நேர் மின்அயனிகள் | அமெரிசியம் டையாக்சைடு பெர்க்கிலியம்(IV) ஆக்சைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகு- நேரடியாக பகுதிக்கூறுகள் இணைந்து வினைபுரிவதால் கியூரியம்(IV) ஆக்சைடு உருவாகிறது. இதற்காக உலோக கியூரியம் ஆக்சிசன் சூழலில் காய்ச்சிப் பதனிட்டு வினைக்கு உட்படுத்தப்படுகிறது. :[1]
- Cm + O2 → CmO2
- கியூரியம்(III) ஐதராக்சைடு மற்றும் கியூரியம்(III) ஆக்சலேட்டு ஆகியவையும் கியூரியம்(IV) ஆக்சைடு தயாரிப்புக்குப் பயன்படுத்தப்படுகின்றன:
- Cm(OH)4 → CmO2 + 2H2O
- Cm(C2O4)2 → CmO2 + 2CO2 + 2CO
- கியூரியம்(III) ஆக்சைடை ஆக்சிசன் சூழலில் 650 பாகை செல்சியசு வெப்பநிலைக்கு சூடுபடுத்தி தயாரிப்பது மற்றொரு முறையாகும்:[2]
- 2Cm2O3 + O2 → 4CmO2
இயற்பியல் பண்புகள்
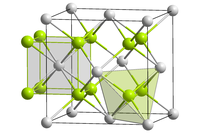
தொகுகியூரியம்(IV) ஆக்சைடு கருப்பு நிறப் படிகங்களாக உருவாகிறது.[3] இது நீரில் கரையாது. சேர்மத்தின் படிகங்கள் கனசதுரப் படிக அமைப்பில் Fm3m இடக்குழுவில் புளோரைட்டு அமைப்பில் உள்ளன.
வேதியியல் பண்புகள்
தொகுகனிம அமிலங்களுடன் கியூரியம்(IV) ஆக்சைடு வினைபுரிந்து கியூரியம்(III) உப்புகளை உருவாக்குகிறது.[4]
பயன்கள்
தொகுஇச்சேர்மம் ஐசோடோபிக் மின்னோட்ட மூலங்களின் உற்பத்திக்காகவும், தாண்டல்கியூரியம் தனிமங்களின் தயாரிப்பிற்கான இலக்காகவும் பயன்படுத்தப்படுகிறது.
மேற்கோள்கள்
தொகு- ↑ Asprey, L. B.; Ellinger, F. H.; Fried, S.; Zachariasen, W. H. (March 1955). "EVIDENCE FOR QUADRIVALENT CURIUM: X-RAY DATA ON CURIUM OXIDES 1" (in en). Journal of the American Chemical Society 77 (6): 1707–1708. doi:10.1021/ja01611a108. பன்னாட்டுத் தர தொடர் எண்:0002-7863. https://pubs.acs.org/doi/abs/10.1021/ja01611a108. பார்த்த நாள்: 29 June 2023.
- ↑ Noé, M.; Fuger, J. (1 May 1971). "Self-radiation effects on the lattice parameter of 244CmO2" (in en). Inorganic and Nuclear Chemistry Letters 7 (5): 421–430. doi:10.1016/0020-1650(71)80177-0. பன்னாட்டுத் தர தொடர் எண்:0020-1650. https://www.sciencedirect.com/science/article/abs/pii/0020165071801770?via%3Dihub. பார்த்த நாள்: 29 June 2023.
- ↑ Konings, R. J. M. (1 October 2001). "Thermochemical and thermophysical properties of curium and its oxides" (in en). Journal of Nuclear Materials 298 (3): 255–268. doi:10.1016/S0022-3115(01)00652-3. பன்னாட்டுத் தர தொடர் எண்:0022-3115. https://www.sciencedirect.com/science/article/abs/pii/S0022311501006523?via%3Dihub. பார்த்த நாள்: 29 June 2023.
- ↑ Lumetta, Gregg J.; Thompson, Major C.; Penneman, Robert A.; Eller, P. Gary (2006). "Curium" (in en). The Chemistry of the Actinide and Transactinide Elements (Springer Netherlands): 1397–1443. doi:10.1007/1-4020-3598-5_9. https://link.springer.com/chapter/10.1007/1-4020-3598-5_9. பார்த்த நாள்: 29 June 2023.