குளோரின் பெர்குளோரேட்டு
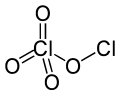
குளோரின் பெர்குளோரேட்டு (Chlorine perchlorate) என்பது Cl2O4. என்ற மூலக்கூற்று வாய்ப்பாடுடன் கூடிய ஒரு வேதிச் சேர்மம்|வேதிச் சேர்மமாகும்]]. குளோரினின் இந்த ஆக்சைடு ஒரு சமச்சீரற்ற ஆக்சைடு ஆகும். ஏனெனில் இதிலுள்ள குளோரின் அணுக்களில் ஒன்று +1 ஆக்சிசனேற்ற நிலையிலும் மற்றோரு குளோரின் அணு +7 ஆக்சிசனேற்ற நிலையிலும் உள்ளன. இதனுடைய சரியான மூலக்கூறை எழுத வேண்டுமெனில் ClOClO3. என்று எழுதலாம்.அறை வெப்பநிலையில் குளோரின் ஈராக்சைடு| ஈராக்சைடை 436 நா.மீ புறஊதா ஒளியில் ஒளிச்சிதைவுக்கு உட்படுத்தினால் குளோரின் பெர்குளோரேட்டு உண்டாகிறது:[2][3]
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
குளோரிம் பெர்குளோரேட்டு
| |||
| முறையான ஐயூபிஏசி பெயர்
குளோரோ ஒஎர்குளோரேட்டு[1] | |||
| வேறு பெயர்கள்
குளோரின்(I,VII)ஆக்சைடு
இருகுளோரின்நான்காக்சைடு | |||
| இனங்காட்டிகள் | |||
| 27218-16-2 | |||
| ChemSpider | 147540 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 168667 | ||
| |||
| பண்புகள் | |||
| Cl2O4 | |||
| வாய்ப்பாட்டு எடை | 134.90 g·mol−1 | ||
| தோற்றம் | வெளிர் பச்சை திரவம் | ||
| அடர்த்தி | 1.81 கி செ.மீ−3 | ||
| உருகுநிலை | −117 °C (−179 °F; 156 K) | ||
| கொதிநிலை | 20 °C (68 °F; 293 K) (சிதைவடையும்) | ||
| வினைபுரியும் | |||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிசனேற்றி | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
- 2 ClO2 → ClOClO3
−45 °செ வெப்பநிலையில் பின்வரும் முறையிலும் பெர்குளோரேட்டைத் தயாரிக்க முடியும்.
- CsClO4 + ClOSO2F → Cs(SO3)F + ClOClO3
வெளிர் பச்சைநிறத் திரவமான குளோரின் பெர்குளோரேட்டு அறை வெப்பநிலையில் சிதைவடைகிறது.
பண்புகள்
தொகுகுளோரின் ஈராக்சைடைக் காட்டிலும் இது நிலைப்புத் தன்மை மிக்கது ஆகும். மற்றுமிது அறைவெப்ப நிலையில் ஆக்சிசன், குளோரின் மற்றும் இருகுளோரின் அறுவாக்சைடுகளாகச் சிதைவடைகிறது.
உலோக குளோரைடுகளுடன் குளோரின் பெர்குளோரேட்டு வினைபுரிந்து நீரற்ற பெர்குளோரேட்டுகளாக மாறுகிறது.
- CrO2Cl2 + 2 ClOClO3 → 2 Cl2 + CrO2(ClO4)2
- TiCl4 + 4 ClOClO3 → 4 Cl2 + Ti(ClO4)4
மேற்கோள்கள்
தொகு- ↑ "Chloro Perchlorate - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ↑ A. J. Schell-Sorokin, D. S. Bethune, J. R. Lankard, M. M. T. Loy, P. P. Sorokin (1982). "Chlorine perchlorate a major photolysis product of chlorine dioxide". J. Phys. Chem. 86 (24): 4653–4655. doi:10.1021/j100221a001.
- ↑ M. I. Lopez, J. E. Sicre (1988). "Ultraviolet spectrum of chlorine perchlorate". J. Phys. Chem. 92 (2): 563–564. doi:10.1021/j100313a062.