தயோசயனோசன்
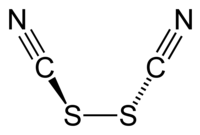
தயோசயனோசன் (Thiocyanogen) என்ற சேர்மத்தின் வாய்ப்பாடு (SCN)2 ஆகும். இது ஒரு போலி உப்பீனி ஆகும். தயோசயனேட்டு என்ற போலி ஆலைடுகளில் இருந்து பெறப்படுகிறது.[1] இதன் ஆக்சிசனேற்ற திறனானது புரோமினைக் காட்டிலும் அதிகம் ஆகும். இது நீருடன் பின்வருமாறு வினையில் ஈடுபடுகிறது.[2]
| |

| |

| |
| இனங்காட்டிகள் | |
|---|---|
| 505-14-6 | |
| ChEBI | CHEBI:30063 |
| ChemSpider | 61468 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 68160 |
| |
| பண்புகள் | |
| C2N2S2 | |
| வாய்ப்பாட்டு எடை | 116.16 g mol−1 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
3(SCN)2 + 4H2O → H2SO4 + HCN + 5SCN− + 5H+
இச்சேர்மமானது உண்மையில் அயோடினுடன் டை எத்தில் ஈதரில் கரைக்கப்பட்ட வெள்ளி தயோசயனேட்டுத் தொங்கலின் வினையினால் பெறப்படுகிறது.[3] ஆனால் இந்த வினையானது அயோடினின் பலவீனமான ஆக்சிசனேற்ற சக்தியின் காரணமாக போட்டியிடும் சமநிலை வினையால் பாதிக்கப்படுகிறது. இதே ஆய்வுகள் சோடர்பேக்கை சல்பர் டைசயனைடு சேர்மத்தைத் தனிமைப்படுத்த வழிவகுத்தது. தயோசயனோசனைத் தயாரிப்பதற்கான மேம்பட்ட வழிமுறையானது காரீய(II) நைட்ரேட்டு மற்றும் சோடியம் தையோசயனேட்டு ஆகியவற்றின் நீர்க்கரைசல்களை ஆக்சிசனேற்ற வினைக்கு உட்படுத்தும் போது காரீய தயோசயனேட்டை வீழ்படிவாகத் தரும் வினை மூலம் கிடைக்கிறது. நீரற்ற Pb(SCN)2 -இன் தொங்கல் கரைசலானது அசிட்டிக் அமிலத்தில் உள்ள புரோமினுடன் வினைப்பட்டு 0.1M தயோசயனோசன் கரைலைத் தருகிறது. இச்சேர்மம் ஒரு சில நாள்கள் இருக்கும் நிலைத்தன்மை உடையது.[4] Alternatively, a solution of bromine in methylene chloride is added to a suspension of Pb(SCN)2 in methylene chloride at 0 °C.[5]
- Pb(SCN)2 + Br2 → (SCN)2 + PbBr2
மேற்கோள்கள்
தொகு- ↑ Jensen, James (2005). "Vibrational frequencies and structural determination of thiocyanogen". Journal of Molecular Structure: THEOCHEM 714 (2–3): 137–141. doi:10.1016/j.theochem.2004.09.046. https://zenodo.org/record/1259391.
- ↑ Stedman, G.; Whincup, P. A. E. (1969). "Oxidation of metal thiocyanates by nitric and nitrous acids. Part I. Products". Journal of the Chemical Society A: Inorganic, Physical, Theoretical: 1145. doi:10.1039/j19690001145. பன்னாட்டுத் தர தொடர் எண்:0022-4944.
- ↑ Söderbäck, Erik (1919). "Studien über das freie Rhodan". Justus Liebig's Annalen der Chemie 419 (3): 217–322. doi:10.1002/jlac.19194190302. https://zenodo.org/record/1427649.
- ↑ Gardner, William Howlett; Weinberger, Harold (1939). "Chapter 29: Thiocyanogen Solution, in Inorganic Syntheses". Inorganic Syntheses 1: 84–86. doi:10.1002/9780470132326.ch29. பன்னாட்டுத் தரப்புத்தக எண்:978-0-470-13232-6.
- ↑ Block, E; Birringer, M; DeOrazio, R; Fabian, J; Glass, RS; Guo, C; He, C; Lorance, E et al. (2000). "Synthesis, Properties, Oxidation, and Electrochemistry of 1,2-Dichalcogenins". J. Am. Chem. Soc. 122 (21): 5052–5064. doi:10.1021/ja994134s.