நிக்கல் பார்மேட்டு
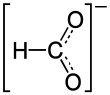
நிக்கல் பார்மேட்டு (Nickel formate) Ni(HCOO)2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு வேதிச் சேர்மமாகும். பார்மிக் அமிலத்தின் நிக்கல் உப்பு நிக்கல் பார்மேட்டாக உருவாகிறது.
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
நிக்கல்(2+) இருபார்மேட்டு
| |
| முறையான ஐயூபிஏசி பெயர்
நிக்கல் பார்மேட்டு | |
| வேறு பெயர்கள்
நிக்கல் இருபார்மேட்டு
| |
| இனங்காட்டிகள் | |
| [1] 3349-06-2[1] 15694-70-9 (இருநீரேற்று) 15843-02-4 | |
| ChemSpider | 25597 35294216 |
| EC number | 222-101-0, 239-946-6 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 27506 |
| |
| UNII | Y4YT27N8QN |
| பண்புகள் | |
| C2H2NiO4 | |
| வாய்ப்பாட்டு எடை | 148.73[2] |
| தோற்றம் | பச்சை நிறத் திண்மம்[2][3] |
| மணம் | மணமற்றது |
| அடர்த்தி | 2.154 கி/செ.மீ3[2] |
| உருகுநிலை | 130–140°செல்சியசு[2] |
| கொதிநிலை | 180–200° செல்சியசு வேப்பநிலையில் சிதையும் [2] |
| குளிர் நீரில் சிறிதளவு கரையும்.[2] | |
| கரைதிறன் | கரையாது[4] காடிகளில் கரையும்s[3] |
| கட்டமைப்பு | |
| படிக அமைப்பு | ஒற்றைச்சாய்வு |
| தீங்குகள் | |
| GHS pictograms |    [2] [2]
|
| GHS signal word | அபாயம் |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகுநிக்கல்(II) அசிட்டேட்டு அல்லது நிக்கல்(II) ஐதராக்சைடுடன்[3] பார்மிக் அமிலத்தைச் சேர்த்து வினைபுரியச் செய்வதன் மூலம் நிக்கல் பார்மேட்டு தயாரிக்கப்படுகிறது.[5]
- Ni(OH)3 + 2HCOOH → Ni(HCOO)2 + 2 H2O
சோடியம் பார்மேட்டுடன் நிக்கல்(II) சல்பேட்டு சேர்மத்தை வினைபுரியச் செய்வதன் மூலமும் நிக்கல் பார்மேட்டு தயாரிக்கப்படுகிறது.[3]
பண்புகள்
தொகுஓர் இருநீரேற்றாக நிக்கல் பார்மேட்டு பச்சை நிறங்கொண்டு மணமற்றதாகவும் எளிதில் தீப்பிடிக்காத ஒரு திண்மப் பொருளாக காணப்படுகிறது. தண்ணீரில் சிறிதளவு கரைகிறது.[2] கட்டமைப்பில் ஒற்றைச்சரிவு கொண்ட படிக அமைப்பைக் கொண்டுள்ளது.[3] 130-140 °செல்சியசு வெப்பநிலையில் இல் கவனமாக சூடாக்கும்போது நீரிலியாக உருவாகிறது.[6] வெற்றிடத்தில் 300 பாகை செல்சியசு வெப்பநிலை வரை சூடாக்கப்படும் போது தூய நிக்கல் உருவாகிறது.[5]
பயன்கள்
தொகுநிக்கல் மற்றும் நிக்கல் வினையூக்கிகள் போன்ற பிற நிக்கல் சேர்மங்களின் உற்பத்தியில் நிக்கல் பார்மேட்டு பயன்படுத்தப்படுகிறது.[4]
மேற்கோள்கள்
தொகு- ↑ https://pubchem.ncbi.nlm.nih.gov/compound/Nickel-formate#section=Molecular-Formula வார்ப்புரு:Bare URL inline
- ↑ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Record of Nickeldiformat in the GESTIS Substance Database of the Institute for Occupational Safety and Health, accessed on 2016-07-23.
- ↑ 3.0 3.1 3.2 3.3 3.4 வார்ப்புரு:HSDB
- ↑ 4.0 4.1 Milne, G. W. A. (2005). Gardner's Commercially Important Chemicals Synonyms, Trade Names, and Properties. John Wiley & Sons. p. 738. பன்னாட்டுத் தரப்புத்தக எண் 0-471-73661-9.
- ↑ 5.0 5.1 Kotz, John; Treichel, Paul; Townsend, John (2009). Chemistry and Chemical Reactivity, Enhanced Edition. Cengage Learning. p. 335. பன்னாட்டுத் தரப்புத்தக எண் 978-0-495-39029-9.
- ↑ Falbe, Jürgen; Regitz, Manfred (2014). RÖMPP Lexikon Chemie, 10. Auflage, 1996-1999 Band 4: M - Pk. Georg Thieme Verlag. p. 2238. பன்னாட்டுத் தரப்புத்தக எண் 3-13-200031-0.