வளையபுரோப்பனோன்
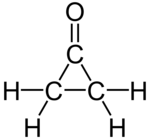
வளையபுரோப்பனோன் (Cyclopropanone) என்பது C3H4O என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கரிம வேதியியல் சேர்மமாகும். வளையபுரோப்பேன் கார்பன் கட்டமைப்புடன் கீட்டோன் வேதி வினைக்குழுவை இச்சேர்மம் கொண்டுள்ளது. சைக்ளோபுரோப்பனோன் என்ற பெயராலும் இச்சேர்மம் அழைக்கப்படுகிறது. இதன் தாய்ச் சேர்மம் −90 ° செல்சியசு வெப்பநிலை என்ற நிலையற்ற உருகுநிலையைக் கொண்டதாக உள்ளது. கீட்டீனுடன் ஈரசோமெத்தேனை −145 ° செல்சியசு வெப்பநிலையில் வினைபுரியச் செய்தால் இச்சேர்மத்தை உருவாக்கலாம்[1][2]. சைக்ளோபுரோப்பனோனின் வழிப்பொருட்கள் கரிம வேதியியலில் முக்கியத்துவம் மிக்க சேர்மங்களாகக் கருதப்படுகின்றன[3].
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
சைக்ளோபுரோப்பனோன்
| |
| இனங்காட்டிகள் | |
| 5009-27-8 | |
| ChemSpider | 122027 |
| யேமல் -3D படிமங்கள் | Image Image |
| பப்கெம் | 138404 |
| |
| பண்புகள் | |
| C3H4O | |
| வாய்ப்பாட்டு எடை | 56.06326 |
| அடர்த்தி | 0.867 கி/மி.லி, 25 °செல்சியசு வெப்பநிலையில் |
| உருகுநிலை | −90 |
| கொதிநிலை | 50 முதல் 53, 22 மி.மீபாதரச அழுத்தத்தில் |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
கரிமத்தொகுப்பு வினைகளில் சைக்ளோபுரோப்பனோன் மட்டும் சைக்ளோபுரோப்பனோன்யெத்தில் எமியசிட்டால்[4] அல்லது சைக்ளோபுரோப்பனோன்யெத்தில் டிரைமெத்தில்சிலில் அசிட்டால்[5] போன்ற அசிட்டால்களால் பதிலீடு செய்யப்படுகிறது.
வழிப்பொருட்கள்
தொகுபேவோர்சிகை மறுசீரமைப்பு வினையில் வளைய கீட்டோன்களுடன் வளையபுரோப்பனோன்களும் இடைநிலை விளைபொருட்களாக உருவாகின்றன. இங்கு கார்பாக்சிலிக் அமில உருவாக்கம் வளைய ஆக்கத்துடன் உடன் நிகழ்கிறது.
பியுரான் போன்ற வளைய டையீன்களுடன், வளையக்கூட்டு வினைகளில் பங்கேற்கும்போது வளையபுரோப்பேன் ஒரு 1,3-இரு முனையனாக பங்களிப்பது ஓர் ஆர்வமூட்டும் செயல்முறையாகும்[6][7]. ஓர் ஆக்சியல்லைல் இடைநிலை விளைபொருள் அல்லது சி2-சி3 பிணைப்பு உடைவதால் உருவாகும் இணைதிறன் அமைப்புமாற்ற சமநிலை ஆகியவை இச்சேர்மத்தை ஓரு திறன்மிக்க இடைநிலை என்று பரிந்துரைக்கின்றன.
பரிசோதனை ஆதாரங்கள் உறுதியானவையாக இல்லை. சைக்ளோபுரோப்பனோன்களின் மற்ற வினைகள் இந்த இடைநிலை வழியாக நடைபெறுகின்றன. உதாரணமாக, தூய எதிருரு (+) - மாறுபக்க -2,3-டி-மூன்றாமை-பியூட்டைல்வளையபுரோப்பனோன் 80° செல்சியசு வெப்பநிலைக்கு சூடாக்கும்போது உயிர்ப்பற்ற கலவையாகிறது[8].
3,5-ஈரைதரோ-4H-பைரசோல்-4-ஓன் சேர்மத்திலிருந்து நைட்ரசனை வெளியேற்றி இண்டேனாக மாற்றும் ஒளிவேதியியல் வினையிலும் ஆக்சியல்லைல் இடைநிலை விளைபொருள் முன்மொழியப்படுகிறது:[9]
இவ்வினையில் ஆக்சியல்லைல் இடைநிலை விளைபொருள் A சைக்ளோபுரோபனோன் B உடன் வேதிச்சமநிலையில் பீனைல் வளையத்தைத் தாக்குகிறது. இதனால் திரிநிலை 1,3-வளையயெக்சாடையீன் C மீள் அரோமாட்டிக்காதலுடன் உருவாகிறது. முதல் இரு நிலைகளான A மற்றும் B இடையில் நிலவும் ஆற்றல் வேறுபாடு 5 முதல் 7 கிலோகலோரி/மோல் ஆகும்.
மேற்கோள்கள்
தொகு- ↑ Preparation and characterization of cyclopropanone, methylcyclopropanone, 2,2-dimethylcyclopropanone and tetramethylcyclopropanone N. J. Turro and W. B. Hammond, Tetrahedron, Volume 24, Issue 18, 1968, Pages 6017-6028 எஆசு:10.1016/S0040-4020(01)90985-8
- ↑ Cryochemical synthesis and molecular energetics of cyclopropanone and some related compounds E. F. Rothgery, R. J. Holt, H. A. McGee,, Jr. J. Am. Chem. Soc.; 1975; 97(17); 4971-4973. எஆசு:10.1021/ja00850a034
- ↑ Cyclopropanones Nicholas J. Turro, Acc. Chem. Res.; 1969; 2(1); 25-32. எஆசு:10.1021/ar50013a004
- ↑ Organic Syntheses, Coll. Vol. 7, p.131 (1990); Vol. 63, p.147 (1985). [Link http://www.orgsynth.org/orgsyn/pdfs/CV7P0131.pdf]
- ↑ Datasheet commercial supplier Link பரணிடப்பட்டது 2007-09-26 at the வந்தவழி இயந்திரம்
- ↑ Cyclopropanones. XII. Cycloaddition reactions of cyclopropanones Nicholas J. Turro, Simon S. Edelson, John R. Williams, Thomas R. Darling, Willis B. Hammond, J. Am. Chem. Soc.; 1969; 91(9); 2283-2292. எஆசு:10.1021/ja01037a018
- ↑ Cyclopropanones. XVII. Kinetics of the cycloaddition reaction of cyclopropanones with 1,3-dienes Simon S. Edelson, Nicholas J. Turro J. Am. Chem. Soc.; 1970; 92(9); 2770-2773. எஆசு:10.1021/ja00712a030
- ↑ Thermal reactions of a cyclopropanone. Racemization and decarbonylation of trans-2,3-di-tert-butylcyclopropanone Frederick D. Greene, David B. Sclove, Jose F. Pazos, Ronald L. Camp J. Am. Chem. Soc.; 1970; 92(25); 7488-7488. எஆசு:10.1021/ja00728a051
- ↑ First Direct Detection of 2,3-Dimethyl-2,3-diphenylcyclopropanone Andrey G. Moiseev, Manabu Abe, Evgeny O. Danilov, and Douglas C. Neckers, J. Org. Chem.; 2007; 72(8) pp 2777 - 2784; (Article) எஆசு:10.1021/jo062259r