அலுமினியம் ஐதரைடு
அலுமினியம் ஐதரைடு (Aluminium hydride) என்பது AlH3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். அலேன் அல்லது அலுமேன் என்ற பெயர்களாலும் இச்சேர்மம் அழைக்கப்படுகிறது. நிறமற்றதாகவும் உடன் தீப்பற்றும் திண்மமாகவும் அலுமினியம் ஐதரைடு காணப்படுகிறது. ஆய்வகங்களைத் தாண்டி அரிதாக எப்போதாவது வெளிப்புற பகுதிகளிலும் இதைக் காணமுடிகிறது. அலேனும் அதன் வழிப்பொருட்களும் கரிமத் தொகுப்பு வினைகளில் ஒடுக்கும் முகவர்களாகப் பயன்படுகின்றன[1].
| |
| பெயர்கள் | |
|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
அலுமினியம் ஐதரைடு | |
| முறையான ஐயூபிஏசி பெயர்
அலுமேன் | |
| வேறு பெயர்கள்
அலேன்
அலுமினிக் ஐதரைடு | |
| இனங்காட்டிகள் | |
| 7784-21-6 | |
| ChEBI | CHEBI:30136 |
| ChemSpider | 13833 17625618 (3H3) |
Gmelin Reference
|
245 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 14488 14399066 (2H3) 16721258 (3H3) |
| |
| பண்புகள் | |
| AlH3 | |
| வாய்ப்பாட்டு எடை | 29.99 கி/மோல் |
| தோற்றம் | வெண்படிகத் திண்மம், ஆவியாகாது, உயர்பலபடியானது, ஊசி வடிவ படிகங்கள் |
| அடர்த்தி | 1.477 கி/செ.மீ3, திண்மம் |
| உருகுநிலை | 150 °C (302 °F; 423 K) 105 °C (221 °F) இல் சிதைவடையும் |
| வினைபுரியும் | |
| கரைதிறன் | ஈதரில் கரையும் எத்தனால் உடன் வினைபுரியும் |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-11.4 கிலோயூல்/மோல் |
| நியம மோலார் எந்திரோப்பி S |
30 கிலோ/மோல் கெல்வின் |
| வெப்பக் கொண்மை, C | 40.2 யூல்/மோல் கெல்வின் |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
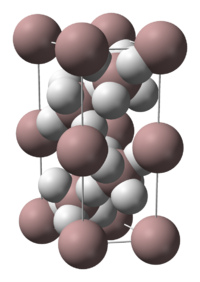
கட்டமைப்பு
தொகுஅலேன் ஒரு பலபடிச் சேர்மமாகும். எனவே இதன் வாய்ப்பாடு சில சமயங்களில் (AlH3)n.என குறிப்பிடப்படுகிறது. எண்ணற்ற பல்லுருவத் தோற்றங்களை அலேன் வெளிப்படுத்துகிறது. α-அலேன், α’-அலேன், β-அலேன், γ-அலேன், δ-அலேன், ε-அலேன் மற்றும் ζ-அலேன் என்று இப்பல்லுருவத் தோற்றங்கள் பெயரிடப்பட்டு அழைக்கப்படுகின்றன. α-அலேன் கனசதுர அல்லது சாய்சதுர புறவடிவமைப்பியலையும், அதேவேளையில் α’-அலேன் ஊசிவடிவப் படிகங்களாகவும், γ-அலேன் இணைக்கப்பட்ட ஊசிகள் கட்டாகவும் படிகமாகின்றன. டெட்ரா ஐதரோபியூரானிலும் ஈதரிலும் அலேன் கரைகிறது. ஈதரிலிருந்து அலேன் வீழ்படிவாகப் படியும் வினையின் வேகமானது அது தயாரிக்கும் முறையைப் பொறுத்து மாறுபடுகிறது [2]
. α-அலேனின் படிகக் கட்டமைப்பை உறுதிபடுத்த முடிகிறது. அலுமினியம் அணுக்கள் ஆறு ஐதரசன் அணுக்களால் சூழப்பட்டு ஆறு பிற அலுமினியம் அணுக்களுடன் பாலம் அமைக்கின்றன. Al-H அணுக்களுக்கிடையே உள்ள தொலைவு சமமாக 172 பைக்கோமீட்டராக உள்ளது மேலும் Al-H-Al அணுக்களின் பிணைப்புக் கோணம் 141° ஆகவும் உள்ளது [3].
வெப்பவியலின்படி α-அலேன் மிகுந்த நிலைப்புத்தன்மை கொண்ட பல்லுருவத் தோற்றமாகும். β-அலேன் மற்றும் γ-அகேன் இரண்டும் ஒன்றாகவே உற்பத்தி செய்யப்படுகின்றன. இவற்றை சூடுபடுத்தி இவற்றிலிருந்து α-அலேனைத் தயாரிக்க முடியும். வெப்பவியல் நிலைப்பித்தன்மை குறைவு என்றாலும் δ, ε, மற்றும் θ-அலேன்களை மற்ற படிகமாக்கும் நிபந்தனைகளால் உருவாக்க முடியும். ஆனால் δ, ε, மற்றும் θ பல்லுருவத் தோற்றங்களை சூடுபடுத்தி α-அலேனைத் தயாரிக்க முடியாது[2].
அலேனின் மூலக்கூற்று வடிவங்கள்
தொகுஓருறுப்பு AlH3 களை குறைந்த வெப்பநிலையில் ஒரு திண்ம மந்தவாயு அணிக்கோவையாகத் தனித்துப் பிரிக்கமுடியும். இவை சமதள வடிவமைப்பில் காணப்படுகின்றன[4]. ஈருறுப்பு Al2H6 மூலக்கூறுகள் திட ஐதரசனில் தனித்துப் பிரிக்கப்படுகின்றன. இது டைபோரேன் (B2H6), டைகாலேன் (Ga2H6) ஆகியவற்றின் வடிவமைப்புடன் ஒத்துள்ளது[5][6].
தயாரிப்பு
தொகுஅலுமினியம் ஐதரைடுகள் மற்றும் அவற்றின் பல்வேறு அணைவுச் சேர்மங்கள் நீண்ட காலமாகவே அறியப்பட்டுள்ளன[7]. அலேனின் முதலாவது தயாரிப்பு முறை 1947 ஆம் ஆண்டு வெளியிடப்பட்டது. இத்தொகுப்பு முறைக்கான காப்புரிமையும் 1999 ஆம் ஆண்டில் வழங்கப்பட்டது [8][9].
இலித்தியம் அலுமினியம் ஐதரைடுடன் அலுமினியம் டிரைகுளோரைடைச் சேர்த்து சூடுபடுத்தி அலுமினியம் ஐதரைடு தயாரிக்கப்படுகிறது [10]. இச்செயல்முறை சிக்கலானது என்பதால் இலித்தியம் குளோரைடை வெளியேற்றுவதில் கவனம் தேவை.
- 3 LiAlH4 + AlCl3 → 4 AlH3 + 3 LiCl
பல்லுறுப்புத் தோற்றத்தில் உள்ள வேதிப்பொருள் விரைவாக திண்மமாக வீழ்படிவாகிவிடும் என்பதால் அலேனின் ஈதர் கரைசலை உடனடியாகப் பயன்படுத்தி விடவேண்டும். அலுமினியம் ஐதரைடு கரைசல்கள் மூன்று நாட்களுக்குப் பின்னர் சிதைவடையத் தொடங்கும். இலித்தியம் அலுமினியம் ஐதரைடை விட அலுமினியம் ஐதரைடு வினைத்திறன் மிக்கது ஆகும்.[2] அலுமினியம் ஐதரைடைத் தயாரிக்க பல்வேறு வகையான தயாரிப்பு முறைகள் உள்ளன.
- 2 LiAlH4 + BeCl2 → 2 AlH3 + Li2BeH2Cl2
- 2 LiAlH4 + H2SO4 → 2 AlH3 + Li2SO4 + 2 H2
- 2 LiAlH4 + ZnCl2 → 2 AlH3 + 2 LiCl + ZnH2
மின்வேதியியல் தொகுப்பு முறை
தொகுமின்வேதியியல் முறையில் அலேனை தொகுக்க பலவழிமுறைகள் உள்ளன[11][12][13][14][15]. அலேன் தயாரிக்க உதவும் பல்வேறு மின்வேதியியல் முறைகள் காப்புரிமை பெற்றுள்ளன[16][17]. இம்முறையில் தயாரிக்கப்படும் அலேனில் குளோரைடு மாசுக்கள் இருப்பதில்லை. அலேனைத் தயாரிப்பதற்குச் சாத்தியமுள்ள இரண்டு வழிமுறைகள் விவாதிக்கப்படுகின்றன. கிளெய்சன் மின்வேதியியல் செல்லில் டெட்ரா ஐதரோ பியூரான் கரைப்பானாகப் பயன்படுகிறது. சோடியம் அலுமினியம் ஐதரைடு மின்பகுளியாகச் செயல்படுகிறது. அலுமினியம் நேர்மின் வாயாகவும் பாதரசத்தில் மூழ்கியுள்ள இரும்பு கம்பி எதிர்மின் வாயாகவும் செயல்படுகின்றன.
பக்க வினைகள் ஏதும் நிகழாமல் பாதுகாக்கப்பட்டு நேர்மின்வாயுடன் சேர்ந்து சோடியம் இரசக்கலவையாக உருவாகிறது. முதல் வினையில் ஐதரசன் உருவாகிறது. இந்த ஐதரசன் மீண்டும் சோடியம் பாதச இரசக் கலவையுடன் வினைபுரிந்து சோடியம் ஐதரைடு உருவாகிறது. கிளெய்சன் திட்டத்தில் தொடக்க வினைபொருள்களில் இழப்பு ஏதும் ஏற்படுவதில்லை. கரையாத நேர்மின் வாயில் முதல் வினையைக் காணலாம்.
- 1.AlH4− - e− → AlH3 • nTHF + ½H2
கரையக்கூடிய நேர்மின் வாய் எனில் இரண்டாம் வினையின்படி நேர்மின் வாய் கரைந்து உருகும் என எதிர்பார்ப்பு உள்ளது.
- 2.3AlH4− + Al - 3e− → 4AlH3 • nTHF
இரண்டாவது வினையில் அலுமினியம் நேர்மின்வாய் பயன்படுத்தப்படுகிறது. இதனால் கொடுக்கப்பட்ட மின்வேதியியல் செல்லில் அலுமினியம் ஐதரைடு உற்பத்தி கட்டுப்படுத்தப்படுகிறது. படிகமாதலும் மின்வேதியியல் முறையில் உருவான அலேனில் இருந்து அலுமினியம் ஐதரைடை மீளப்பெறுதலும் செய்து காட்டப்பட்டன[14][15].
உயர் அழுத்த ஐதரசனேற்றல்
தொகுஅலுமினியம் உலோகத்தை 10 கிகாபாசுக்கல் அழுத்தத்தில் 600 பாகை செல்சியசு வெப்பநிலையில் ஐதரசனேற்றம் செய்தால் α-AlH3 உருவாகிறது. திரவமாக்கப்பட்ட ஐதரசன் அலுமினியத்துடன் வினைபுரிந்து α-AlH3 உருவாகிறது. வெளிச்சூழலில் ஆல்பா-அலுமினியம் ஐதரைடு சேகரிக்கப்படுகிறது [18].
வினைகள்
தொகுலூயிசு காரங்களுடன்
தொகுவலிமையான இலூயிசு காரங்களுடன் AlH3 வினைபுரிந்து கூட்டு விளைபொருட்களைக் கொடுக்கிறது. உதாரணமாக இவையிரண்டும் 1:1 மற்றும் 1:2 அணைவுகளாக டிரைமெத்திலமீனாக உருவாகின்றன. வாயு நிலையில் 1:1 அணைவு நான்முகி வடிவத்திலுள்ளது[19]. ஆனால் திண்ம நிலையில் இது பாலம் அமைக்கும் ஐதரசன் மையங்களுடன் ஈருருவத் தோற்றம் (NMe3Al(μ-H))2. அளிக்கிறது[20]. 1:2 அணைவு முக்கோண இரட்டைப் பட்டைக்கூம்பு வடிவத்தை ஏற்கிறது[19] டைமெத்திலெத்திலமீன் அலேன் போன்ற சில கூட்டு விளைபொருள்கள் வெப்பச்சிதைவு அடைந்து அலுமினியம் உலோகத்தைத் தருகின்றன. கரிமவுலோக ஆவிப்படிவு முறைகளில் இது பயன்படுத்தப்படுகிறது[21].
டை எத்தில் ஈதருடன் இதன் அணைவு பின்வருமாறு உருவாகிறது.
AlH3 + (C2H5)2O → H3Al • O(C2H5)2
ஈதரிலுள்ள இலித்தியம் ஐதரைடுடன் வினைபுரிந்து இலித்தியம் அலுமினியம் ஐதரைடைக் கொடுக்கிறது.:
AlH3 + LiH → LiAlH4
வேதி வினைக்குழுக்கள் ஒடுக்கம்
தொகுகரிம வேதியியலில் வேதி வினைக்குழுக்களை ஒடுக்குவதற்காக அலுமினியம் ஐதரைடைப் பயன்படுத்துவார்கள்[22]. அலுமினியம் ஐதரைடின் செயல்பாடுகள் பலவழிகளில் இலித்தியம் அலுமினியம் ஐதரைடின் செயல்பாடுகளை ஒத்துள்ளன. ஆல்டிகைடுகள், கீட்டோன்கள், கார்பாக்சிலிக் அமிலங்கள், நீரிலிகள், அமிலகுளோரைடுகள், எசுத்தர்கள், லாக்டோன்கள் ஆகியவற்றை அவற்றுடன் தொடர்புள்ள ஆல்ககால்களாக அலுமினியம் ஐதரைடு ஒடுக்கம் செய்கிறது. அமைடுகள், நைட்ரைல்கள், ஆக்சைம்கள் ஆகியனவற்றை அவற்றுடன் தொடர்புள்ள அமைன்களாக ஒடுக்கம் செய்கிறது.
வேதி வினைக்குழு தேர்வில் அலேன் பிற ஐதரைடு வினைப்பொருள்களிலிருந்து மாறுபடுகிறது. உதாரணமாக கீழே கொடுக்கப்பட்டுள்ள வளையயெக்சனோன் ஒடுக்க வினையில் இலித்தியம் அலுமினியம் ஐதரைடு 1.9:1 என்ற விகிதத்தில் டிரான்சு:சிசு மாற்றியங்களைத் தருகிறது. ஆனால் அலுமினியம் ஐதரைடு 7.3:1 என்ற விகிதத்தில் கொடுக்கிறது[23]
சில கீட்டோன்களிலுள்ள C-H பிணைப்பை C-CH2OH பிணைப்பால் இடப்பெயர்ச்சி செய்து ஐதராக்சிமெத்திலேற்றம் செய்வதற்கு அலேன் வழிசெய்கிறது. கீட்டோன் மட்டும் ஒடுக்கப்படாமல் ஈனோலேட்டாக பாதுகாக்கப்படுகிறது [24] The ketone itself is not reduced as it is "protected" as its enolate.
.
கரிம ஆலைடுகள் மிக மெதுவாக ஒடுக்கமடைகின்றன அல்லது அலுமினியம் ஐதரைடால் முழுவதுமாக ஒடுக்கம் அடைவதில்லை. எனவே கார்பாக்சிலிக் அமிலம் போன்ற வினைத்திறன் மிக்க வேதி வினைக்குழுக்கள் ஆலைடுகள் முன்னிலையில் ஒடுக்கப்படுகின்றன [25]
.
நைட்ரோ குழுக்கள் அலுமினியம் ஐதரைடால் ஒடுக்கப்படுவதில்லை. அதேபோல அலுமினியம் ஐதரைடு ஓர் எசுத்தரை ஒடுக்கும் போது நைட்ரோ குழுக்களின் முன்னிலை அவசியமாகிறது[26]
.
அசிட்டால்களை டையால்களாக ஒடுக்க அலுமினியம் ஐதரைடு பயன்படுத்தப்படுகிறது[27]
.
ஈபாக்சைடு வளைய திறப்பு வினைகளிலும் அலுமினியம் ஐதரைடைப் பயன்படுத்தமுடியும்[28]
.
அல்லைலிக் மறுசீராக்கல் வினையையும் அலுமினியம் ஐதரைடு நிகழ்த்துகிறது[29]
.
கார்பன் டை ஆக்சைடை சூடுபடுத்தி மீத்தேனாக ஒடுக்கம் செய்வதிலும் அலுமினியம் ஐதரைடு பயன்படுகிறது.
- 4 AlH3 + 3 CO2 → 3 CH4 + 2 Al2O3
ஐதரோ அலுமினேற்றம்
தொகுபுரோபார்கைலிக் ஆல்ககால்களுடன் அலுமினியம் ஐதரைடு சிறிதளவு சேர்க்கப்படுகிறது [30]. தைட்டானியம் டெட்ராகுளோரைடுடன் சேர்த்து வினைப்படுத்தும்போது அலுமினியம் ஐதரைடு இரட்டைப் பிணைப்புகளுக்கு குறுக்காக இணைகிறது [31]. ஐதரோபோரானேற்றமும் இதைப்போன்றதொரு வினையாகும்.
எரிபொருள்
தொகுஐதரசன் எரிபொருளால் இயங்கும் வாகனங்களுக்கு ஐதரசனை சேமித்து வைக்க அலுமினியம் ஐதரைடு பயன்படுத்துவது குறித்து விவாதிக்கப்படுகிறது. AlH3 இல் அதன் எடையில் 10% ஐதரசன் கலந்துள்ளது. இது 148கிராம்/லிட்டருக்கு சமமாகும். நீர்ம ஐதரசனின் அடர்த்தியை விட இது இரண்டு மடங்காகும். ALH3 என்பது ஐதரசனின் தலைகீழ் வினையாக நிகழவில்லை [32]. ராக்கெட் எரிபொருள் மற்றும் வெடிபொருள் மற்றும் வானவேடிக்கை கலவைகளில் இதை சேர்த்துப் பயன்படுத்துவதற்கான சாத்தியங்கள் உள்ளன.
முன் எச்சரிக்கை
தொகுஅலுமினியம் ஐதரைடு உடனடியாகத் தீப்பற்றுவதில்லை என்றாலும் இலித்தியம் அலுமினியம் ஐதரைடு போலவே இதுவும் தீவிர வினைத்திறன் மிக்கதாகும். நீர் மற்றும் காற்றில் அலுமினியம் ஐதரைடு சிதைவடையும். இவ்விரண்டுடன் அதி தீவிரமான வினைகள் நிகழவும் சாத்தியங்கள் உள்ளன. அலுமினியம் ஆக்சைடு பாதுகாப்பு அடுக்காக கருதாப்படுவதால் காற்றில் பயன்படுத்துகையில் அலுமினியம் ஐதரைடை பாதுகாப்புடன் கையாளவேண்டும் [32].
மேற்கோள்கள்
தொகு- ↑ Brown, H. C.; Krishnamurthy, S. (1979). "Forty Years of Hydride Reductions". Tetrahedron 35 (5): 567–607. doi:10.1016/0040-4020(79)87003-9.
- ↑ 2.0 2.1 2.2 US application 2007066839, Lund, G. K.; Hanks, J. M.; Johnston, H. E., "Method for the Production of α-Alane"
- ↑ Turley, J. W.; Rinn, H. W. (1969). "The Crystal Structure of Aluminum Hydride". Inorganic Chemistry 8 (1): 18–22. doi:10.1021/ic50071a005.
- ↑ Kurth, F. A.; Eberlein, R. A.; Schnöckel, H.-G.; Downs, A. J.; Pulham, C. R. (1993). "Molecular Aluminium Trihydride, AlH3: Generation in a Solid Noble Gas Matrix and Characterisation by its Infrared Spectrum and ab initio Calculations". Journal of the Chemical Society, Chemical Communications 1993 (16): 1302–1304. doi:10.1039/C39930001302.
- ↑ Andrews, L.; Wang, X. (2003). "The Infrared Spectrum of Al2H6 in Solid Hydrogen". Science 299 (5615): 2049–2052. doi:10.1126/science.1082456. பப்மெட்:12663923. Bibcode: 2003Sci...299.2049A.
- ↑ Pulham, C. R.; Downs, A. J.; Goode, M. J.; Rankin D. W. H.; Robertson, H. E. (1991). "Gallane: Synthesis, Physical and Chemical Properties, and Structure of the Gaseous Molecule Ga2H6 as Determined by Electron Diffraction". Journal of the American Chemical Society 113 (14): 5149–5162. doi:10.1021/ja00014a003.
- ↑ Brower, F. M.; Matzek, N. E.; Reigler, P. F.; Rinn, H. W.; Roberts, C. B.; Schmidt, D. L.; Snover, J. A.; Terada, K. (1976). "Preparation and Properties of Aluminum Hydride". Journal of the American Chemical Society 98 (9): 2450–2454. doi:10.1021/ja00425a011.
- ↑ Finholt, A. E.; Bond, A. C. Jr.; Schlesinger, H. I. (1947). "Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry". Journal of the American Chemical Society 69 (5): 1199–1203. doi:10.1021/ja01197a061.
- ↑ US patent 6228338, Petrie, M. A.; Bottaro, J. C.; Schmitt, R. J.; Penwell, P. E.; Bomberger, D. C., "Preparation of Aluminum Hydride Polymorphs, Particularly Stabilized α-AlH3", issued 2001-05-08
- ↑ Schmidt, D. L.; Roberts, C. B.; Reigler, P. F.; Lemanski, M. F. Jr.; Schram, E. P. (1973). "Aluminum Trihydride-Diethyl Etherate: (Etherated Alane)". Inorganic Syntheses. Inorganic Syntheses 14: 47–52. doi:10.1002/9780470132456.ch10. பன்னாட்டுத் தரப்புத்தக எண்:9780470132456.
- ↑ Alpatova, N. M.; Dymova, T. N.; Kessler, Yu. M.; Osipov, O. R. (1968). "Physicochemical Properties and Structure of Complex Compounds of Aluminium Hydride". Russian Chemical Reviews 37 (2): 99–114. doi:10.1070/RC1968v037n02ABEH001617. Bibcode: 1968RuCRv..37...99A.
- ↑ Semenenko, K. N.; Bulychev, B. M.; Shevlyagina, E. A. (1966). "Aluminium Hydride". Russian Chemical Reviews 35 (9): 649–658. doi:10.1070/RC1966v035n09ABEH001513. Bibcode: 1966RuCRv..35..649S.
- ↑ Osipov, O. R.; Alpatova, N. M.; Kessler, Yu. M. (1966). "none". Elektrokhimiya 2: 984.
- ↑ 14.0 14.1 Zidan, R.; Garcia-Diaz, B. L.; Fewox, C. S.; Stowe, A. C.; Gray, J. R.; Harter, A. G. (2009). "Aluminium hydride: a reversible material for hydrogen storage". ChemComm (25): 3717–3719. doi:10.1039/B901878F.
- ↑ 15.0 15.1 Martinez-Rodriguez, M. J.; Garcia-Diaz, B. L.; Teprovich, J. A.; Knight, D. A.; Zidan, R. (2012). "Advances in the electrochemical regeneration of aluminum hydride". Applied Physics A: Materials Science & Processing 106 (25): 545–550. doi:10.1007/s00339-011-6647-y. Bibcode: 2012ApPhA.106..545M.
- ↑ DE patent 1141623, Clasen, H., "Verfahren zur Herstellung von Aluminiumhydrid bzw. aluminiumwasserstoffreicher komplexer Hydride", issued 1962-12-27, assigned to Metallgesellschaft
- ↑ US patent 8470156, Zidan, R., "Electrochemical process and production of novel complex hydrides", issued 2013-06-25, assigned to Savannah River Nuclear Solutions, LLC
- ↑ Saitoh, H; Sakurai, Y; Machida, A; Katayama, Y; Aoki, K (2010). "In situX-ray diffraction measurement of the hydrogenation and dehydrogenation of aluminum and characterization of the recovered AlH3". Journal of Physics: Conference Series 215: 012127. doi:10.1088/1742-6596/215/1/012127. பன்னாட்டுத் தர தொடர் எண்:1742-6596. Bibcode: 2010JPhCS.215a2127S.
- ↑ 19.0 19.1 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ Atwood, J. L.; Bennett, F. R.; Elms, F. M.; Jones, C.; Colin L. Raston; Robinson, K. D. (1991). "Tertiary Amine Stabilized Dialane". Journal of the American Chemical Society 113 (21): 8183–8185. doi:10.1021/ja00021a063.
- ↑ Yun, J.-H.; Kim, B.-Y.; Rhee, S.-W. (1998). "Metal-Organic Chemical Vapor Deposition of Aluminum from Dimethylethylamine Alane". Thin Solid Films 312 (1–2): 259–263. doi:10.1016/S0040-6090(97)00333-7. Bibcode: 1998TSF...312..259Y.
- ↑ Galatsis, P. (2001). "Encyclopedia of Reagents for Organic Synthesis". Encyclopedia of Reagents for Organic Synthesis. DOI:10.1002/047084289X.rd245. பன்னாட்டுத் தரப்புத்தக எண் 978-0-470-84289-8.
- ↑ Ayres, D. C.; Sawdaye, R. (1967). "The Stereoselective Reduction of Ketones by Aluminium Hydride". Journal of the Chemical Society B 1967: 581–583. doi:10.1039/J29670000581. https://archive.org/details/sim_journal-of-the-chemical-society-b_1967_b_6/page/581.
- ↑ Corey, E. J.; Cane, D. E. (1971). "Controlled Hydroxymethylation of Ketones". Journal of Organic Chemistry 36 (20): 3070–3070. doi:10.1021/jo00819a047.
- ↑ Jorgenson, Margaret J. (July 1962). "Selective reductions with aluminum hydride". Tetrahedron Letters 3 (13): 559–562. doi:10.1016/S0040-4039(00)76929-2.
- ↑ Takano, S.; Akiyama, M.; Sato, S.; Ogasawara, K. (1983). "A Facile Cleavage of Benzylidene Acetals with Diisobutylaluminum Hydride" (pdf). Chemistry Letters 12 (10): 1593–1596. doi:10.1246/cl.1983.1593. http://www.jstage.jst.go.jp/article/cl1972/12/10/12_10_1593/_pdf.
- ↑ Richter, W. J. (1981). "Asymmetric Synthesis at Prochiral Centers: Substituted 1,3-Dioxolanes". Journal of Organic Chemistry 46 (25): 5119–5124. doi:10.1021/jo00338a011.
- ↑ Maruoka, K.; Saito, S.; Ooi, T.; Yamamoto, H. (1991). "Selective Reduction of Methylenecycloalkane Oxides with 4-Substituted Diisobutylaluminum 2,6-Di-tert-butylphenoxides". Synlett 1991 (4): 255–256. doi:10.1055/s-1991-20698. https://archive.org/details/sim_synlett_1991-04_2_4/page/255.
- ↑ Claesson, A.; Olsson, L.-I. (1979). "Allenes and Acetylenes. 22. Mechanistic Aspects of the Allene-Forming Reductions (SN2' Reaction) of Chiral Propargylic Derivatives with Hydride Reagents". Journal of the American Chemical Society 101 (24): 7302–7311. doi:10.1021/ja00518a028.
- ↑ Corey, E. J.; Katzenellenbogen, J. A.; Posner, G. H. (1967). "New Stereospecific Synthesis of Trisubstituted Olefins. Stereospecific Synthesis of Farnesol". Journal of the American Chemical Society 89 (16): 4245–4247. doi:10.1021/ja00992a065.
- ↑ Sato, F.; Sato, S.; Kodama, H.; Sato, M. (1977). "Reactions of Lithium Aluminum Hydride or Alane with Olefins Catalyzed by Titanium Tetrachloride or Zirconium Tetrachloride. A Convenient Route to Alkanes, 1-Haloalkanes and Terminal Alcohols from Alkenes". Journal of Organometallic Chemistry 142 (1): 71–79. doi:10.1016/S0022-328X(00)91817-5.
- ↑ 32.0 32.1 Graetz, J.; Reilly, J.; Sandrock, G.; Johnson, J.; Zhou, W. M.; Wegrzyn, J. (2006). Aluminum Hydride, A1H3, As a Hydrogen Storage Compound. doi:10.2172/899889.
புற இணைப்புகள்
தொகு- Aluminium Hydride on EnvironmentalChemistry.com Chemical Database
- Hydrogen Storage பரணிடப்பட்டது 2006-08-23 at the வந்தவழி இயந்திரம் from Brookhaven National Laboratory
- Aluminum Trihydride on WebElements