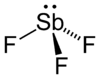
ஆண்டிமனி டிரைபுளோரைடு
ஆண்டிமணி டிரைபுளோரைடு (Antimony trifluoride), SbF3, என்ற மூலக்கூறு வாய்ப்பாட்டை உடைய கனிமச் சேர்மம் ஆகும். சில நேரங்களில் இந்தச் சேர்மம் இசுவார்ட்டின் காரணி எனவும் அழைக்கப்படுகிறது. ஆண்டிமணி தனிமத்தின் இரண்டு முக்கியமான புளோரைடுகளில் இதுவும் ஒன்றாகும். மற்றொன்று ஆண்டிமணி பென்டாபுளோரைடு SbF5 ஆகும். இச்சேர்மமானது வெண்ணிறத் திண்மமாக தோற்றமளிக்கிறது. சில தொழிற்துறை பயன்பாடுகளிலும், கனிம வேதியியலிலும் ஒரு வேதிக்காரணியாகவும் பயன்படுகிறது.[2] ஆர்கனோபுளோரின் வேதியியலிலும் ஒரு முக்கியக் காரணியாகப் பயன்படுகிறது.
| |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
ஆண்டிமணி(III) புளோரைடு | |||
| முறையான ஐயூபிஏசி பெயர்
டிரைபுளோரோஸ்டிபேன் | |||
| வேறு பெயர்கள்
டிரைபுளோரோஆண்டிமணி
| |||
| இனங்காட்டிகள் | |||
| 7783-56-4 | |||
| ChemSpider | 22960 | ||
| EC number | 232-009-2 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 24554 | ||
| வே.ந.வி.ப எண் | CC5150000 | ||
| |||
| UN number | UN 2923 | ||
| பண்புகள் | |||
| SbF3 | |||
| வாய்ப்பாட்டு எடை | 178.76 கி/மோல் | ||
| தோற்றம் | வெளிர் சாம்பல் முதல் வெண்ணிறம் வரை கொண்ட படிகங்கள் | ||
| மணம் | மூக்கைத்துளைக்கும் நெடி | ||
| அடர்த்தி | 4.379 கி/செமீ3 | ||
| உருகுநிலை | 292 °C (558 °F; 565 K) | ||
| கொதிநிலை | 376 °C (709 °F; 649 K) | ||
| 385 கி/100 மிலி (0 °செ) 443 கி/100 மிலி (20 °செ) 562 கி/100 மிலி (30 °செ) | |||
| கரைதிறன் | மெதனால் , அசிட்டோன் ஆகியவற்றில் கரையக்கூடியது அம்மோனியாவில் கரையாதது | ||
| -46.0·10−6 செமீ3/மோல் | |||
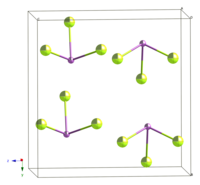
| கட்டமைப்பு | |||
| படிக அமைப்பு | செஞ்சாய்சதுரம், oS16 | ||
| புறவெளித் தொகுதி | Ama2, No. 40 | ||
| தீங்குகள் | |||
| Lethal dose or concentration (LD, LC): | |||
LD50 (Median dose)
|
100 மிகி/கிகி | ||
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |||
அனுமதிக்கத்தக்க வரம்பு
|
TWA 0.5 மிகி/மீ3 (as Sb)[1] | ||
பரிந்துரைக்கப்பட்ட வரம்பு
|
TWA 0.5 மிகி/மீ3 (as Sb)[1] | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
தயாரிப்பு மற்றும் அமைப்பு
தொகுதிட SbF3 இல் மையத்தில் உள்ள Sb அணுவானது எண்முகி மூலக்கூறு அமைப்பைப் பெற்றுள்ளது. மைய அணுவானது புளோரைடு ஈந்தணைவிகளால் இணைக்கப்பட்டுள்ளது. மூன்று Sb–F பிணைப்புகள் குட்டையான பிணைப்பு நீளத்தையும் (192 pm) மற்ற மூன்று பிணைப்புகள் நீண்ட பிணைப்பு நீளத்தையும் (261 pm) கொண்டுள்ளன. இது ஒரு பலபடியாக இருப்பதால், SbF3, AsF3 மற்றும் SbCl3 போன்ற இதர ஒத்த சேர்மங்களுடன் ஒப்பிடும் போது SbF3 யானது மிகவும் குறைவான ஆவியாகும் தன்மையைக் கொண்டுள்ளது.[3]
ஆண்டிமணி டிரைபுளோரைடானது, SbF3, ஆண்டிமணி டிரையாக்சைடு மற்றும் ஐதரசன் புளோரைடு ஆகியவற்றை வினைக்குட்படுத்துவதன் மூலம் தயாரிக்கப்படுகிறது:[4]
- Sb2O3 + 6 HF → 2 SbF3 + 3 H2O
இந்தச் சேர்மமானது ஒரு மென்மையான லுாயிசு அமிலமாகும். இது மெதுவாக நீரில் நீராற்பகுக்கப்படுகிறது. புளோரினோடு இது ஆக்சிசனேற்றம் அடைந்து ஆண்டிமணி பென்டாபுளோரைடைத் தருகிறது.
- SbF3 + F2 → SbF5
பயன்பாடுகள்
தொகுகரிம வேதியியலில் இச்சேர்மம் ஆலசனேற்ற (புளோரினேற்றம்) வினைக்காரணியாகப் பயன்படுகிறது.[5] இந்தப் பயன்பாடானது 1892 ஆம் ஆண்டு பெல்சிய நாட்டு வேதியியலாளாா் பிரெடெரிக் ஜீன் எட்மண்ட் இசுவார்ட்சு என்பவரால் அறிவிக்கப்பட்டது.[6] இவர் குளோரைடு சேர்மங்களை புளோரைடு சேர்மங்களாக மாற்றுவதற்கு இதன் உபயோகத்தன்மையைக் குறித்து செயல்முறை விளக்கமளித்தார்.
இந்த முறையில், ஆண்டிமணி டிரைபுளோரைடினை குளோரின் அல்லது ஆண்டிமணி பென்டாகுளோரைடுடன் வினைப்படுத்தும் போது செயல்படு உறுப்பான ஆண்டிமணி டிரைபுளோரோடைகுளோரைடு(SbCl2F3) கிடைக்கிறது. இந்த சேர்மமானது பெருமளவிலும் தயாரிக்கப்படலாம்.[7] இசுவார்ட்டின் வினயைானது பொதுவாக ஆர்கனோபுளோரின் சேர்மங்களின் தொகுப்பு முறை தயாரிப்புகளுக்குப் பயன்படுத்தப்பட்டன. ஆனால், சிலேன்களைப் பயன்படுத்தியும் ஆய்வுகள் நிகழ்த்தப்பட்டு வருகின்றன.[8] இது பிரியான்களின் தொழில் முறை தயாரிப்பிற்கும் முன்பு பயன்படுத்தப்பட்டுள்ளது. புளோரினைக் கொண்டுள்ள இதர லுாயி அமிலங்களும் ஐதரசன் புளோரைடுடன் இணைந்து புளோரினேற்றக் காரணிகளாக பயன்படுத்தப்படுகின்றன.
ஆண்டிமணி டிரைபுளோரைடானது, SbF3, சாயத்தொழில் மற்றும் மட்பாண்டத் தொழில்களில் சுடுமண் அல்லது பீங்கானில் பயன்படுத்தப்படும் பளபளப்பான பூச்சினைத் தயாரிக்கப் பயன்படுகிறது.
பாதுகாப்பு நடவடிக்கை
தொகுஉயிரைக் கொல்லும் அளவுக்கான நச்சுத்தன்மையின் குறைந்தபட்ச மருந்தளவு (அயல்நாட்டுப் பெருச்சாளி, வாய்வழி) 100 மிகி/கிகி என்ற அளவாக உள்ளது.[9]
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 "NIOSH Pocket Guide to Chemical Hazards #0036". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Sabina C. Grund, Kunibert Hanusch, Hans J. Breunig, Hans Uwe Wolf "Antimony and Antimony Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2006, Wiley-VCH, Weinheim. எஆசு:10.1002/14356007.a03_055.pub2
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY.
- ↑ Tariq Mahmood and Charles B. Lindahl Fluorine Compounds, Inorganic, Antimony in Kirk‑Othmer Encyclopedia of Chemical Technology.எஆசு:10.1002/0471238961.0114200913010813.a01
- ↑ Swarts (1892). "none". Acad. Roy. Belg 3 (24): 474.
- ↑ US 4438088
- ↑ Booth, Harold Simmons; Suttle, John Francis (1946). "IV. The Preparation and Fluorination of Dimethyl and Trimethyl Chlorosilanes". J. Ac. Chem. Soc 68 (12): 2658–2660. doi:10.1021/ja01216a072.
- ↑ Sabina C. Grund, Kunibert Hanusch, Hans J. Breunig, Hans Uwe Wolf “Antimony and Antimony Compounds” in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. எஆசு:10.1002/14356007.a03_055.pub2