தாண்டலம் ஐங்குளோரைடு
தாண்டலம்(V) குளோரைடு (Tantalum(V) chloride), தாண்டலம் ஐங்குளோரைடு, என்றும் அழைக்கப்படும் ஒரு கனிமச் சேர்மம் ஆகும். இதன் மூலக்கூற்று வாய்ப்பாடு TaCl5 ஆகும். இச்சேர்மம் வெண்ணிறத் தூளாகும். இது பொதுவாக தாண்டலம் வேதியியலில் ஒரு தொடக்கப் பொருளாக உள்ளது.
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
தாண்டலம்(V) குளோரைடு
தாண்டலம் ஐங்குளோரைடு | |
| இனங்காட்டிகள் | |
| 7721-01-9 TaCl5 17499-29-5 Ta2Cl10 | |
| EC number | 231-755-6 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24394 |
| |
| UNII | 9WXV40ZI4M |
| பண்புகள் | |
| TaCl5 | |
| வாய்ப்பாட்டு எடை | 358.213 கி/மோல் |
| தோற்றம் | வெண்ணிற ஒற்றைச்சாய்சதுரப்படிகங்கள்[1] |
| அடர்த்தி | 3.68 கி/செமீ3 |
| உருகுநிலை | 216 °C (421 °F; 489 K) |
| கொதிநிலை | 239.4 °C (462.9 °F; 512.5 K) (சிதைகிறது) |
| வினைபுரிகிறது | |
| கரைதிறன் | குளோரோபார்ம், CCl4 |
| +140.0·10−6 செமீ3/மோல் | |
| கட்டமைப்பு | |
| படிக அமைப்பு | ஒற்றைச்சாய்சதுரம், mS72 |
| புறவெளித் தொகுதி | C2/m, No. 12 |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-858.98 கிலோஜூல்/மோல் |
| நியம மோலார் எந்திரோப்பி S |
221.75 ஜூல் கெல்வின்−1மோல்l−1 |
| தீங்குகள் | |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாதது |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
1900 மிகி/கிகி (வாய்வழி, எலி) |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | தாண்டலம்(V) புளோரைடு தாண்டலம்(V) புரோமைடு தாண்டலம்(V) அயோடைடு |
| ஏனைய நேர் மின்அயனிகள் | வனேடியம் நாற்குளோரைடு நியோபியம்(V) குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
இச்சேர்மம் எளிதில் நீராற்பகுக்கப்பட்டு தாண்டலம்(V) ஆக்சிகுளோரைடாக (TaOCl3) மேலும் இறுதியாக தாண்டலம் ஐந்தாக்சைடாக (Ta2O5) மாறுகிறது;
அமைப்பு
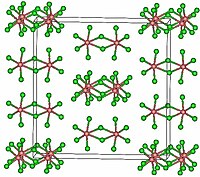
தொகுTaCl5 ஒற்றைச் சாய்சதுர புறவெளித் தொகுதி C2/m படிகமாகிறது.[2] 10 குளோரின் அணுக்கள் ஓரிணை எண்முகிகளின் பொது விளிம்பினை பகிர்ந்து கொள்கின்றன. தாண்டலம் அணுக்கள் எண்முகியின் மையப் பகுதியை ஆக்கிரமித்துக் கொள்கின்றன. மேலும், இவை இரண்டு குளோரின் அணுக்களை இணைப்பாக்கு ஈந்தணைவியாகக் கொண்டு இணைப்பாக்கப்பட்டுள்ளன. இருபடி அமைப்பானது அணைவினை உருவாக்காத கரைப்பான்களாலும், உருகிய நிலையிலும் நிலைத்திருக்கிறது. இருப்பினும், வாயு நிலையில் TaCl5 இச்சேர்மம் ஒற்றைச் சாய்சதுரை அமைப்பைப் பெற்றுள்ளது. இந்த ஒருபடி PCl5 போன்று முக்கோண இருபிரமிடு அமைப்பினைக் கொண்டுள்ளது.[3]
இயற்பியல் பண்புகள்
தொகுதாண்டலம் ஐங்குளோரைடின் கரைதிறன் பின்வரும் அரோமேடிக் ஐதரோகார்பன்கள் பின்வரும் வரிசைப்படி சிறிது சிறிதாக அதிகரிக்கிறது: பென்சீன்< டொலுயீன்< m-சைலீன்< மெசிட்டிலீன். இந்த மாற்றமானது கரைசலின் நிறமானது மஞ்சளிலிருந்து ஆரஞ்சாக அடர்வாவதிலிருந்து இது தெரிகிறது. தாண்டலம் ஐங்குளோரைடானது வளையஎக்சேனில் கார்பன் டெட்ராகுளோரைடில் கரைவதைக் காட்டிலும் குறைவாகக் கரைகிறது. தாண்டலம் ஐங்குளோரைடின் இத்தகு கரைசல்கள் குறைவான அயனியாக்கத்தின் காரணமாக மிக மோசமான கடத்தும் பண்பினைப் பெற்றுள்ளன. TaCl5 பதங்கமாதல் முறையினைப் பயன்படுத்தி தூய்மையாக்கப்படும் போது வெண்ணிற ஊசிகளாக கிடைக்கின்றது.
தொகுப்பு முறை தயாரிப்பு
தொகுதாண்டலம் ஐங்குளோரைடானது தூளாக்கப்பட்ட உலோக தாண்டலம் மற்றும் குளோரின் வாயு இவற்றை 170 - 250 °செல்சியசு வெப்பநிலையில் நேரடி வினைக்கு உட்படுத்துவதன் மூலம் தயாரிக்கப்படுகிறது. இந்த வினையானது 400 °செல்சியசு வெப்பநிலையில் ஐதரசன் குளோரைடினைப் பயன்படுத்தியும் நிகழச் செய்யப்படுகிறது.[4]
- 2 Ta + 5 Cl2 → 2 TaCl5
- 2 Ta + 10 HCl → 2 TaCl5 + 5 H2
240 ° செல்சியசு வெப்பநிலையில் தாண்டலம் பென்டாக்சைடு மற்றும் தயோனைல் குளோரைடு ஆகியவற்றுக்கிடையேயான வினையின் மூலமாகவும் தயாரிக்கப்படுகிறது.
- Ta2O5 + 5 SOCl2 → 2 TaCl5 + 5 SO2
தாண்டலம் ஐங்குளோரைடு வணிகரீதியல் கிடைக்கின்றது. இருப்பினும் இதனோடு நீராற்பகுப்பின் காரணமாக உருவான டாண்டலம்(V) ஆக்சிகுளோரைடு (TaOCl3) சிறிதளவு மாசுப்பொருளாக கலந்திருக்க வாய்ப்புள்ளது.
வினைகள்
தொகுTaCl5 எலக்ட்ரான் கவர் தன்மை இருப்பதால், AlCl3 போன்ற ப்ரீடல்-கிராப்ட்ஸ் வகை வினையூக்கியயாக செயல்படுகிறது. இதன் காரணமாக, பல்வேறு லூயி காரங்களுடன் இது சேர்க்கைப் பொருட்களைத் தருகிறது.[5]
எளிய சேர்க்கைப் பொருட்கள்
தொகுTaCl5 ஈதர்களுடன் நிலையான அணைவுச்சேர்மங்களைத் தருகிறது:
- TaCl5 + R2O → TaCl5(OR2) (R = Me, Et)
TaCl5 பாசுபரசு ஐங்குளோரைடு மற்றும் பாசுபரசு ஆக்சிகுளோரைடு ஆகியவற்றுடன் வினைபுரிகிறது. பாசுபரசு ஐங்குளோரைடு குளோரினை வழங்கும் சேர்மமாகவும், பாசுபரசு ஆக்சி குளோரைடு ஈந்தணைவியாகவும் செயலபட்டு ஆக்சிசன் மூலமாக பிணைப்பை ஏற்படுத்துகிறது:
- TaCl5 + PCl5 → [PCl4+][TaCl6−]
- TaCl5 + OPCl3 → [TaCl5(OPCl3)]
தாண்டலம் ஐங்குளோரைடு மூவிணைய அமீன்களுடன் வினைபுரிந்து படிக வடிவமுள்ள சேர்க்கைப் பொருட்களைத் தருகின்றது.
- TaCl5 + 2 R3N → [TaCl5(NR3)]
குளோரைடு இடப்பெயர்ச்சி வினைகள்
தொகுதாண்டலம் ஐங்குளோரைடு அறை வெப்பநிலையில் அதிகளவு முப்பினைல் பாசுபீன் ஆக்சைடுடன் வினைபுரிந்து ஆக்சி குளோரைடுகளைத் தருகின்றது:
- TaCl5 + 3 OPPh3 → [TaOCl3(OP(C6H5)3]x ...
TaCl5 மற்றும் ஐதராக்சில் சேர்மங்களான ஆல்ககால்கள், பீனால்கள் மற்றும் கார்பாக்சிலிக் அமிலங்கள் ஆகியவற்றிற்கிடைப்பட்ட வினையில் முன்னதாக ஊகிக்கப்பட்ட சேர்க்கை விளைபொருட்கள் உருவாதல் என்பது ஐதரசன் குளோரைடு நீக்கம் மற்றும் Ta-O பிணைப்புகள் உருவாக்கத்தைத் தொடர்ந்து நடக்கிறது:
- TaCl5 + 3 HOEt → TaCl2(OEt)3 + 3 HCl
HCl ஏற்பியாக உள்ள அம்மோனியாவின் முன்னிலையில், அனைத்து ஐந்து குளோரைடு ஈனிகளும் Ta(OEt)5 உருவாக்கத்துடன் இடப்பெயர்ச்சி செய்யப்படுகின்றன. இதே போன்று TaCl5நீரற்ற மெதனாலில் உள்ள இலித்தியம் மீத்தாக்சைடுடன் வினைபுரிந்து தொடர்புடைய மீதாக்சி வழிப்பொருட்களை உருவாக்குகிறது:
- TaCl5 + 4LiOMe → Ta(OMe)4Cl + 4LiCl
மேற்கோள்கள்
தொகு- ↑ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. பன்னாட்டுத் தரப்புத்தக எண் 0-8493-0487-3.
- ↑ Rabe, Susanne; Müller, Ulrich (2000). "Crystal structure of tantalum pentachloride, (TaCl5)2". Z. Kristallogr. - New Cryst. Struct. 215 (1): 1–2. doi:10.1515/ncrs-2000-0102.
- ↑ F. Fairbrother (1967). The Chemistry of Niobium and Tantalum. Elsevier.
- ↑ Young, Ralph C.; Brubaker, Carl H. (1952). "Reaction of Tantalum with Hydrogen Chloride, Hydrogen Bromide and Tantalum Pentachloride; Action of Hydrogen on Tantalum Pentachloride". Journal of the American Chemical Society 74 (19): 4967. doi:10.1021/ja01139a524.
- ↑ F. A. Cotton, G. Wilkinson, Advanced Inorganic Chemistry (4th ed.), Wiley, New York, 1980.