நைட்ரோசில்கந்தக அமிலம்
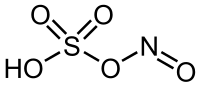
நைட்ரோசில்கந்தக அமிலம் (Nitrosylsulfuric acid ) என்பது NOHSO4 என்ற மூலக்கூறு வாய்ப்பாடுடன் கூடிய ஒர் வேதிச் சேர்மமாகும். நிறமற்ற திண்மப்பொருளான இச்சேர்மம் காப்ரோலாக்டம் ((CH2)5C(O)NH.) என்ற கரிமச் சேர்மத்தைத் தொழில் முறையில் தயாரிக்கப் பயன்படுகிறது[1].
| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
நைட்ரோசில்சல்பூரிக் அமிலம்
| |
| வேறு பெயர்கள்
nitrosonium bisulfate, chamber crystals
| |
| இனங்காட்டிகள் | |
| 7782-78-7 | |
| ChemSpider | 74147 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 82157 |
| |
| பண்புகள் | |
| HNO5S | |
| வாய்ப்பாட்டு எடை | 127.08 கி/மோல் |
| தோற்றம் | வெளிர் மஞ்சள் படிகங்கள் |
| அடர்த்தி | 1.612 கி/மி.லி 40% கந்தக அமிலக் கரைசல் |
| உருகுநிலை | 73.5 °C (164.3 °F; 346.6 K) |
| கொதிநிலை | சிதைவடையும் |
| சிதைவடையும் | |
| கரைதிறன் | H2SO4 இல் கரையும் |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிகரணி |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | NOCl |
| ஏனைய நேர் மின்அயனிகள் | NaHSO4 |
| தொடர்புடைய சேர்மங்கள் | NOBF4 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பும் வேதி வினைகளும்
தொகுசோடியம் நைட்ரைட்டை சுழி பாகை செல்சியசு வெப்பநிலையில் உள்ள அடர்த்தியான கந்தக அமிலத்தில் கரைத்து நைட்ரோசில்கந்தக அமிலம் தயாரிக்கலாம்:[2][3]
- HNO2 + H2SO4 → NOHSO4 +H2O
கந்தக அமிலத்தின் அமில நீரிலி மற்றும் நைட்ரசு அமிலத்தின் கலப்பு அமிலமாகவும் இம்மூலக்கூறைக் காணமுடியும். மாறாக, நைட்ரிக் அமிலம் மற்றும் கந்தக டைஆக்சைடு இரண்டையும் சேர்த்து வினைப்படுத்துவதன் மூலமாகவும் நைட்ரோசில்கந்தக அமிலம் தயாரிக்க முடியும்[4].
கரிம வேதியியலில் அமீன்களில் இருந்து ஈரசனோனிய உப்புகளை தயாரிக்க நைட்ரோசில்கந்தக அமிலம் பயன்படுகிறது. தொடர்புடைய நைட்ரசு ஆக்சைடு வெளியிடும் செயலிகளில் நைட்ரோசோனியம் நான்கு புளோரோபோரேட்டு ([NO]BF4) மற்றும் நைட்ரோசில் குளோரைடு ஆகியனவும் உள்ளடங்கும்.
மேற்கோள்கள்
தொகு- ↑ Ritz, J.; Fuchs, H.; Kieczka, H.; Moran, W. C. (2002). "Caprolactam". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a05_031.
- ↑ Hodgson, H. H.; Mahadevan, A. P.; Ward, E. R. (1955). "1,4-Dinitronaphthalene". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv3p0341.; Collective Volume, vol. 3, p. 341 (diazodization followed by treatment with nitrite)
- ↑ Sandin, R. B.; Cairns, T. L. (1943). "1,2,3-Triiodo-5-nitrobenzene". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv2p0604.; Collective Volume, vol. 2, p. 604 (diazodization followed by treatment with iodide)
- ↑ Coleman, G. H.; Lillis, G. A.; Goheen, G. E. (1939). "Nitrosyl Chloride". Inorganic Syntheses 1: 55–59. doi:10.1002/9780470132326.ch20. This procedure generates the nitrosylsulfuric acid as an intermediate en route to NOCl.