புரதம் மடிப்படைதல்
இக்கட்டுரை கூகுள் மொழிபெயர்ப்புக் கருவி மூலம் உருவாக்கப்பட்டது. இதனை உரை திருத்த உதவுங்கள். இக்கருவி மூலம்
கட்டுரை உருவாக்கும் திட்டம் தற்போது நிறுத்தப்பட்டுவிட்டது. இதனைப் பயன்படுத்தி இனி உருவாக்கப்படும் புதுக்கட்டுரைகளும் உள்ளடக்கங்களும் உடனடியாக நீக்கப்படும் |
புரத மடிப்பு என்பது பொருள்சார்ந்த செயலாக்கம், இதன் மூலம் ஒரு பல்பெத்தைட்டு எழுந்தமான சுருளிலிருந்து அதன் சிறப்பியல்பான மற்றும் செயல்பாட்டுக்குரிய முப்பரிமாண வடிவமைப்பாக மடிகிறது.[1] mRNA வரிசையிலிருந்து அமினோ அமிலங்களின் நேர்கோட்டுச் சங்கிலியாக மொழிபெயர்க்கும்போது ஒவ்வொரு புரதமும் மடிக்கப்படாத பல்பெத்தைட்டு அல்லது எழுந்தமான சுருளாக இருக்கிறது. இந்த பல்பெத்தைட்டில் எந்தவொரு உருவாக்கப்பட்ட முப்பரிமாண வடிவமைப்பும் இருக்காது (பக்கத்திலுள்ள படத்தில் இடதுபுறம்) இயற்கையான நிலை எனப்படுகின்ற மடிக்கப்பட்ட புரதமான (படத்தின் வலதுபுறம்) நன்கு வரையறுத்த முப்பரிமாண வடிவமைப்பை உருவாக்குவதற்கு அமினோ அமிலங்கள் ஒன்றுடனொன்று இடைவினைபுரிகின்றன. விளைவக வருகின்ற முப்பரிமாண வடிவமைப்பை அமினோ அமிலம் வரிசை தீர்மானிக்கும்.[2]
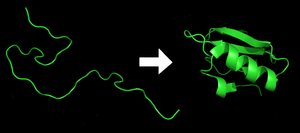
பல புரதங்களுக்கு முப்பரிமாண வடிவமைப்பு என்பது செயல்பாட்டுக்கு அவசியமானது.[3] திட்டமிட்டுள்ள வடிவத்தில் மடிக்கத் தவறுவதால் பொதுவாக நச்சுத்தன்மையான பிரீயான்கள் உட்பட வேறுபட்ட பண்புகளுடனான செயற்படாத புரதங்கள் உருவாகும். பல்வேறு நரம்புசிதைவு மற்றும் பிற நோய்கள் தவறாக மடிக்கப்பட்ட (சரியல்லாமல் மடிக்கப்பட்டது) புரதங்களின் தேக்கத்தால் ஏற்பட்டதென நம்பப்படுகின்றன.[4]
தெரிந்த உண்மைகள்
தொகுமடிப்பு மற்றும் அமினோ அமிலம் வரிசைக்கு இடையேயான தொடர்பு
தொகுபுரதத்தின் அமினோ அமில வரிசை (அல்லது முதன்மை வடிவமைப்பு) அதன் இயற்கையான கட்டமைப்பை வரையறுக்கும். புரதம் மூலக்கூறானது தொகுப்பின் போது அல்லது அதன் பின்னர் தானாகவே மடிகிறது. இந்த பெருமூலக்கூறுகள் "தாமாகவே மடிவதாகக்" கருதப்படுகிறது, இந்த செயலாக்கம் கரைப்பான் (நீர் அல்லது லிப்பிட் இருபடை),[5] உப்புக்களின் செறிவு, வெப்பநிலை மற்றும் மூலக்கூற்று சப்பரோன்கள் இருத்தல் ஆகியவற்றைப் பொறுத்தும் உள்ளது.
மடிந்த புரதங்கள் பொதுவாக நீர்வெறுப்புள்ள மத்தியைக் கொண்டிருக்கும், இதில் பக்கச் சங்கிலி வரிந்துகட்டுதலானது மடிந்த நிலையை உறுதியாக்கும், ஏற்றமுள்ள அல்லது முனைவு பக்கச் சங்கிலிகள் சூழவுள்ள நீருடன் இடைவினைபுரிகின்ற இடமான கரைப்பானுக்கு-வெளிக்காட்டப்பட்ட மேற்பரப்பை நிரப்பும். நீருக்கு வெளிக்காட்டப்படும் நீர்வெறுப்புள்ள பக்க-சங்கிலிகளின் எண்ணிக்கையைக் குறைப்பதென்பது மடித்தல் செயலாக்கத்துக்கு பின்னால் இயக்குகின்ற முக்கியமான விசையாகும்.[6] மூலக்கூறக ஐதரசன் பிணைப்புகளின் உருவாக்கமானது புரத உறுதித்தன்மைக்கு இன்னொரு முக்கியமான பங்களிப்பாகும்.[7] ஐதரசன் பிணைப்புகளின் வலிமை அவற்றின் சூழலில் தங்கியுள்ளது, ஆகவேதான் இயற்கை நிலையின் உறுதித்தன்மைக்கு நீருக்குரிய சூழலுக்கு வெளிக்காட்டிய H-பிணைப்புகளைவிட நீர்வெறுப்புள்ள மத்தியில் உருவாக்கப்பட்ட H-பிணைப்புகள் அதிக பங்களிப்பை வழங்கும்.[8]
கிட்டத்தட்ட நான்கு தசாப்தங்களுக்கு முன்னர் வெளியிடப்பட்ட விந்துவ ஆய்வு பணியில், "புரத களங்களின் இயற்கையான மடிப்பை ஆணையிடுகின்ற தகவலானது அவற்றின் அமினோ அமிலம் வரிசையில் குறியீடு இடப்படுகிறது" என்று சி.பி. அன்ஃபின்சன் எடுகோள் எடுத்துக்கொண்டார்.[9]. இருந்தபோதிலும், ஆமிக்ஸ் யுகத்தின்போது அன்ஃபின்சன் காலத்திலிருந்து, நம்பமறுக்கும் அளவுக்கு அதிகமான புரத வரிசை, வடிவமைப்பு மற்றும் மடிப்புத் தரவுகள் உருவாக்கப்பட்டது, புரத உலகின் வெளிப்படுகின்ற படமானது அன்ஃபின்சனின் கோட்பாட்டுக்கு சவாலாகியது, மிகப்பல புரத மடிப்புகள் நிலையான "மடிப்புக் குறியீடு"[10] இல்லாமல் நம்பமுடியாத வரிசை மாறுபாட்டைக் கொண்டுள்ளது என்பதற்கான சான்றாகியது. இந்த அவதானிப்புக்கு ஆதரவாக, அண்மைக்கால ஆய்வுகள் 1-2% போன்றளவுக்குக் குறைவான வரிசை அடையாளமுடைய புரதங்கள், இப்போதும் அதே இயற்கையான மடிப்புக்கு உள்ளாகும், ஆகவே புரத வரிசைக்குள்[11] மடிப்பை ஆணையிடும் தகவலின் எந்தவொரு உறுதியான குறியீடாக்கமும் மறுக்கப்படுகிறது என்று காண்பித்துள்ளன. மழுப்புகின்ற "மடிப்புக் குறியீட்டின்" பின்தொடர்கையானது குறிப்பிட்ட சில புரதங்களுக்குத் தனித்துவமான அமினோ அமிலம் வரிசைப் பாதுகாப்புகளின் அமைப்புகளைவிட ஓரளவு அதிகமாக தோற்றுவிக்கப்பட்டுள்ளன, ஆனால் உலகளவில் பொதுமைப்படுத்த அல்லது உயிரியல் பயன்பாடுகளுக்குப்[12] பயன்படுத்த எந்தவொரு கண்டுபிடிப்பும் போதியளவுக்கு கட்டாயப்படுத்தவில்லை.
அண்மைக்கால ஆய்வில், 1-பரிமாண அமினோ அமிலம் வரிசை மட்டத்தில் புரத மடிப்புகளுக்குள் பெரிய மாறுபாடு இருந்தபோதிலும், புரத மடிப்பு உருவாக்கத்துடன்[13] அதிக சிக்கலாக தொடர்புள்ளதாக இருக்கும் எனக் கூறப்படும் 2-D (புரதத் தொடர்பு வரைபடங்கள்) அல்லது 3-D (வடிவமைப்பு) போன்ற புரத கட்டங்களின் உயர் பரிமாணங்களில் மடிப்பு-பேணப்பட்ட தகவலை இயற்கை குறியீட்டு இட்டுள்ளது என்பதை ஹவார்ட்-MIT விஞ்ஞானிகள் காட்டியுள்ளனர். PLoS ONE இல் வெளியிடப்பட்ட ஆய்வானது வலையமைப்பு கோட்பாடு அணுகுமுறைகளைப் பயன்படுத்தி, உயர் பரிமாண புரத கட்டத்திலிருந்து மறைந்துள்ள மடிப்பு-பேணப்பட்ட தகவலை வெளிக்காட்டியது. மடிப்பு மடிப்பு அடிப்படையிலுள்ள முழு புரத படைப்பு முழுவதையும் பரிசோதிப்பதன் மூலம், கரைப்பான்-வெளிப்படுத்தாத மத்தி புரதக் களங்களிலுள்ள அணு இடைவிளைவு வலையமைப்புகள் என்பவை மடிப்பு-பேணப்பட்டவை மற்றும் ஒவ்வொரு புரத இயற்கையான மடிப்புக்கும் தனித்துவமானது என்பதை ஆய்வு காண்பித்தது, ஆகவே புரத களங்களின் குறியீடு இடப்பட்ட "கையொப்பங்களாக" தோன்றுகின்றன. ஆகவே, புரத மடிப்புக் குறியீடு என்பது சாதாரணமாக ஊகிக்கப்பட்டதுபோல, வரிசைக்கு மேலதிகமான ஒரு "வலையமைப்புக் கூறு" மற்றும் அமைப்பு ரீதியான கூறு என்பதை இந்த ஆய்வு தெளிவுபடுத்தவில்லை. மடிப்பு-ஆணையிடும் தகவலின் ஒரு குறிப்பிட்ட பகுதியானது புரத களங்களின் கரைப்பானுக்குக் வெளிக்காட்டாத மத்தியிலுள்ள அணு இடைவிளைவி வலையமைப்பு மூலம் குறீயீடு இடப்படுகிறது என்பதைக் கூறுவதன்மூலம் இதுபோன்ற புரத மடிப்பு குறியீட்டின் கண்டுபிடிப்பானது அன்ஃபின்சன்ஸ் டாக்மாவையும் உறுதிப்படுத்துகிறது.
பெரும்பாலும் உயிருள்ளவையில் மடிப்புச் செயலாக்கம் துணை-மொழிபெயர்ப்பாக தொடங்குகிறது, ஆகவே புரதத்தின் C-முனைப் பகுதியானது தொடர்ந்தும் ரைபோசோமால் தொகுக்கப்படுகின்ற வேளை, புரத N-முனை மடியத் தொடங்கும். சாப்பரோன்கள் எனப்படுகின்ற சிறப்புவாய்ந்த புரதங்கள் பிற புரதங்களின் மடிப்பில் உதவுகிறது.[14] நன்கு ஆராயப்பட்ட எடுத்துக்காட்டு பாக்டீரியாl GroEL தொகுதியாகும், இது கோளவடிவமுள்ள புரதங்களின் மடிப்பில் உதவுகிறது. யூக்கரியோட்டிக் உயிரங்கிகளில் சாப்பரோன்கள் வெப்ப அதிர்ச்சிப் புரதங்கள் எனப்படுகின்றன. பெரும்பாலான கோளவடிவமுள்ள புரதங்கள் அவற்றின் இயற்கையான நிலையை தனியானதாகக் கருதிக்கொள்ளக் கூடியவை என்றபோதும், கூட்டமான கலங்களுக்குள்ளான சூழலில் திரளலைத் தடுப்பதற்கு சாப்பரோன் துணையான மடிப்பு பெரும்பாலும் தேவைப்படுகிறது; கலச் சூழலில் வெப்பத்துக்கு அல்லது பிற மாற்றங்களுக்கு வெளிக்காட்டப்படுவதன் விளைவாக ஏற்படக்கூடிய தவறான மடிப்பையும் திரளலையும் தடுக்கவும் சாப்பரோன்கள் பயன்படுத்தப்படுகின்றன.
அநேகமான பாகத்துக்கு, ஒருதன்மையான பல மூலக்கூறுகள் ஒட்டுமொத்தமாக ஒன்றாக மடிக்கின்றன என்பதை விஞ்ஞானிகளால் ஆய்வுசெய்ய முடிந்துள்ளது. மிகவும் பெரிய அளவினதான மட்டத்தில், இயற்கையான நிலைக்கு மாறுபடுகின்றபோது, வழங்கப்பட்ட அமினோ அமில வரிசையானது கிட்டத்தட்ட அதே வழியில் சென்று கிட்டத்தட்ட அதே இடைநிலைகள் மற்றும் நிலைமாறும் நிலைகள் வழியாகத் தொடரும் எனத் தோன்றுகிறது. பெரும்பாலும் மடிப்பானது முதலில் வழக்கமான இரண்டாம்நிலை மற்றும் உயர் இரண்டாம்நிலை வடிவமைப்புகள் உருவாக்கத்தில் குறிப்பாக ஆல்ஃபா சுருள்கள் மற்றும் பீட்டா தாள்கள் ஆகியவற்றை உள்ளாக்கி, பின்னர் மூன்றாம்நிலை வடிவமைப்பை உள்ளாக்கும். பொதுவாக நான்காம்நிலை வடிவமைப்பு உருவாக்கமானது முன்பே மடிக்கப்பட்டுள்ள துணைப்பிரிவுகளின் "கூட்டம்" அல்லது "துணைக்கூட்டத்தை" உள்ளாக்கும். வழக்கமான ஆல்ஃபா சுருள் மற்றும் பீட்டா தாள் வடிவமைப்புகள் விரைவாக மடியும், ஏனெனில் லினஸ் பௌலிங் முதலில் குறிப்பிட்டதுபோல, அவை மூலக்கூறக ஐதரசன் பிணைப்புகளால் உறுதிப்படுத்தப்படும். புரத மடிப்பானது இரண்டு சிஸ்டீன் எச்சங்களுக்கிடையே உருவாக்கப்பட்ட இருசல்பைட் பாலங்கள் வடிவில் சகஇணைப்பு பிணைப்பு அல்லது உலோக கொத்துகள் உருவாக்கத்துக்கு உள்ளாகலாம். அவற்றின் ஆற்றலை வெளிக்காட்டுவதில் சாதகமான இயல்பான கட்டமைப்பை அடைவதற்குச் சற்று முன்னதாக, இடைநிலையான "உருகிய கோள" நிலையூடாக மூலக்கூறுகள் செல்லக்கூடும்.
இருந்தபோதிலும் மடிப்பின் அவசியமான விஷயமானது ஒவ்வொரு புரதத்தினதும் அமினோ அமில வரிசை இயல்பான நிலை மற்றும் அந்நிலையை அடைவதற்கான பாதை இரண்டையும் குறிப்பிடுகின்ற தகவல்களைக் கொண்டிருக்கும் என்பதில் நீடித்திருக்கும். இது கிட்டத்தட்ட ஒரேமாதிரியான அமினோ அமில வரிசைகள் எப்போதுமே ஒரேமாதிரி மடியும் என்பதைக் குறிப்பிடாது.[15] கட்டமைப்புகள் சூழல் காரணிகளைப் பொறுத்தும் வேறுபடும்; ஒத்த புரதங்கள் அவை காணப்படும் இடத்தைப் பொறுத்து வேறுவகையில் மடியும். மடிதல் என்பது ஒரு தன்னிச்சையான செயலாக்கம், நியூக்கிளியோசைட்டு முப்பாஸ்பேட்டுகளிலிருந்தான சக்தி உள்ளீடுகளின் சார்பற்றவை. மடிந்த நிலையின் நிலைமாற்றத்தை பிரதானமாக நீர்வெறுப்புள்ள இடைவினைகள், மூலக்கூறக ஐதரசன் பிணைப்புகள் உருவாக்கம் மற்றும் வன் டர் வால்ஸ் விசைகள் ஆகியன வழிநடத்தும், மேலும் இதை கட்டமைப்புரீதியான இயல்பாற்றல் தடைசெய்ய்ம்.
இயல்பான நிலைச் சீர்குலைவு
தொகுசில நிலமைகளின்கீழ் புரதங்கள் அவற்றின் உயிரிரசாயனத்துக்குரிய செயல்பாட்டு வடிவங்களாக மடிவதில்லை. கலங்கள் வாழக்கூடிய வரம்புக்கு அதிகமான அல்லது குறைவான வெப்பநிலைகள் வெப்பரீதியாக உறுதியில்லாத புரதங்களை மடியவிடமாட்டாது அல்லது "செயலிழக்கச் செய்யும்" (இதன் காரணமாகவே வேகவைக்கும்போது முட்டை வெள்ளைக்கரு ஒளிபுகவிடாததாக மாறுகிறது). கரைப்பான்களின் உயர் செறிவுகள், pH இன் உச்ச அளவுகள், பொறிமுறை விசைகள் மற்றும் செயலிழக்கச் செய்கின்ற வேதிய பிற பொருள்கள் இருத்தல் ஆகியவையும் அதையே செய்யக்கூடியன. இருந்தபோதிலும், புரதத்தின் வெப்ப உறுதித்தன்மையானது மாறிலியாக இருக்கவே இருக்காது. எடுத்துக்காட்டாக, ஹைப்பர்தெர்மோபீலிக் பாக்டீரியா 122 °C வெப்பநிலையிலும் வளர்வதாகவும்,[16] இதற்கு அவை உயிர்வாழ அவசியமான புரதங்கள் மற்றும் புரதக் கூட்டங்களின் முழுமையான நிரப்புக் கூறும் அந்த வெப்பநிலையில் அல்லது அதற்கும் அதிகமான வெப்பநிலையில் உறுதியாக இருப்பதும் தேவை என்பதும் கண்டுபிடிக்கப்பட்டுள்ளது.
முழுவதுமாக செயலிழக்கச் செய்யப்பட்ட புரதத்தில் மூன்றாம் நிலை மற்றும் இரண்டாம் நிலை வடிவமைப்புகள் இரண்டுமே இருக்காது, மேலும் அது தோராயமான சுருள் எனப்படுவது போலவே இருக்கும். சில குறிப்பிட்ட நிலைமைகளின்கீழ், சில புரதங்கள் மீண்டும் மடியலாம்; இருந்தபோதிலும், செயலிழப்பு என்பது மீளுந்தன்மை அற்றது.[17] சில வேளைகளில், மடிப்பு மற்றும் மடித்தபடியே இருத்தல் ஆகிய இரண்டிலும் பிற புரதங்களுக்குத் துணைபுரியும் சாப்பரோன்கள் அல்லது வெப்ப அதிர்ச்சி புரதங்கள் எனப்படுகின்ற நொதியங்களைப் பயன்படுத்தி வெப்பத்தின் செயலிழக்கச் செய்யும் தாக்கத்திலிருந்து கலங்கள் தமது புரதங்களைக் காக்கும். சாப்பரோன் மூலக்கூறுகளின் துணையுடன் அன்றி சில புரதங்கள் ஒருபோதுமே கலங்களில் மடியாது, சாப்பரோன் மூலக்கூறுகள் தனித்த புரதங்களை பிரிக்கும், ஆகவே அவற்றின் மடிப்பானது பிற புரதங்களுடன் இடைவினைகள் மூலம் குறுக்கீடு செய்யப்படமாட்டா அல்லது சாப்பரோன் மூலக்கூறுகள் தவறுதலாக மடிக்கப்பட்ட புரதங்களின் மடிப்பை நீக்க உதவி, அவை சரியாக மீண்டும் மடிய இரண்டாவது சந்தர்ப்பத்தை வழங்குகின்றன. கரையுந்தன்மையில்லாத படிக உருவமற்ற திரட்டுக்களாக வீழ்படிவாகும் ஆபத்திலிருந்து காக்க இந்த செயல்பாடு மிகவும் முக்கியமாகும்.
தவறான புரத மடிப்பு மற்றும் நரம்புச்சிதைவு நோய்
தொகுCreutzfeldt-Jakob நோய் போன்ற பிரயோன்-தொடர்பான நோய்கள், மாட்டு பைத்திய நோய் (விசர் மாட்டு நோய்), அல்சைமர் நோய் மற்றும் குடும்ப அமைலோயிட்டு இதயத்தசைநோய் அல்லது பலநரம்புகள் கோளாறு போன்ற அமைலோயிட்டு-தொடர்பான நோய்கள், மேலும் ஹன்ரிங்ரொன் மற்றும் and பார்க்கின்சன் நோய் போன்ற குழியவுருவக திரளல் நோய்கள் ஆகியவற்றுடன் திரண்ட புரதங்கள் தொடர்பானவை.[4][18] சிறிய வயதில் வரும் இந்த செயலிழப்பு நோய்கள் தவறாக மடிந்த புரதங்களின் பல மூலக்கூறுகள் கரையுந்தன்மையற்ற, கலத்திற்கு வெளியான மற்றும்/அல்லது குறுக்கு-பீட்டா தாள் அமைலோயிட்டு நுண்நார்கள் உள்ளடங்கலான கலத்திற்கு உள்ளேயான திரட்டுகளுடன் தொடர்பானவை; இந்த திரட்டுகளானவை தொகுப்பு, மடிப்பு, திரளுதல் மற்றும் புரத பரிமாற்ற அளவு ஆகியவற்றுக்கிடையிலான சமநிலையான புரத ஒத்தவொடுக்கத்தின் இழப்பு காரணமாக அல்லது அதன் பிரதிபலிப்பாக மட்டும் உள்ளனவா என்பது தெளிவாகத் தெரியவில்லை. மடிப்பு மற்றும் செயற்பாட்டுக்குப் பதிலாக தவறாக மடிந்து அளவுக்கதிகமான படிச் சிதைவு ஏற்படுதலானது ஆண்டிதிரிப்சின் தொடர்பான காற்றேற்ற விரிவு, சிறு நீர்ப்பையின் நார்க்கட்டிப் பெருக்கம் மற்றும் லைசோச்சோமுக்குரிய சேமிப்பு நோய்கள் போன்ற பல proteopathy நோய்கள் ஏற்பட வழிவகுக்கும், இங்கு செயற்பாடு இழப்பு என்பதே அந்தக் குறைபாட்டின் தொடக்கமாகும். மேலே பிந்தையதாகக் கூறப்பட்டுள்ள குறைபாடுகளைக் குணப்படுத்த புரத மாற்றீட்டுச் சிகிச்சையை காலம்காலமாகப் பயன்படுத்தியுள்ள நிலையில், விகாரமடைந்த புரதங்களுக்கு செயற்பாட்டை வழங்கக்கூடியதாக அவற்றை மடிக்க, வளர்ந்துவரும் ஒரு அணுகுமுறையானது மருந்து சாப்பரோன்களைப் பயன்படுத்தவுள்ளது.
லேவிந்தல் முரண்பாடு மற்றும் இயக்கவியல்
தொகுஒரு புரதமானது சாத்தியமான அனைத்து கட்டமைப்புகளையும் தொடர்ச்சியாக மாதிரியாக்குவதன்மூலன் மடியவுள்ளது எனில், கட்டமைப்புகள் துரித வீதத்தில் (நானோவினாடி அல்லது பீக்கோவினாடி அளவீட்டில்) மாதிரியாக்கப்பட்டால்கூட, அவ்வாறு நடக்க வானளவான நேரத்தை எடுக்கலாம் என லேவிந்தல் முரண்பாடு[19] கண்டறிந்தது. மேற்படி அவதானிப்பை அடிப்படையில், இதைவிட புரதங்கள் மிக வேகமாக மடிகின்றன, தோராயமான கட்டமைப்புத் தேடல் நிகழவில்லை என்றும் ஆகவே அதியுயர்-நிலையான இடைநிலைக் கூறுகள் வரிசையின்வழியாக மடிய வேண்டியது அவசியம் என்றும் லேவிந்தன் பின்னர் முன்மொழிந்தார்.
மடிதல் செயலாக்கம் நடைபெறும் கால அளவானது அதிலீடுபடும் புரதத்தினைப் பொறுத்து வெகுவாக மாறுபடும். கலத்துக்கு வெளியே ஆய்வு செய்தபோது, முதன்மையாக புரோலீன் சமபகுதியாகுதன்மை காரணமாக மிகமெதுவாக மடிகின்ற புரதங்கள் மடிய பல நிமிடங்கள் அல்லது மணி நேரங்கள் தேவைப்படும், மேலும் அச்செயலாக்கம் நிறைவுபெற முன்னர், சோதனைச் சாவடிகள் போன்ற பல இடைநிலைக் கூறுகளைக் கடக்கவேண்டும்.[20] மற்றொருவகையில், நூறு அமினோ அமிலங்கள் வரையான நீளங்கொண்ட மிகவும் சிறிய தனித்த-களப் புரதங்கள் பொதுவாக ஒரேயொரு படியில் மடிகின்றன.[21] மில்லிவினாடிகள் நேர அளவீடுகள் என்பவை நெறிமுறையாகும், மிகவும் வேகமான தெரிந்த புரத மடிப்பு மறுவினைகள் ஒருசில மைக்ரோவினாடிகளில் பூர்த்தியாகின்றன.[22]
புரத மடிப்பின் சக்தி இயற்கைத்தோற்றக் கோட்பாடு
தொகு1980 ஆம் ஆண்டுகள் மற்றும் 1990 ஆம் ஆண்டுகளின் ஆரம்பத்தில், ஜோசப் பிரிஞ்ஜெல்சன் மற்றும் பீட்டர் வோலின்ஸ் ஆகியோர் சக்தி இயற்கைத்தோற்ற கோட்பாட்டை உருவகுக்கும்வரை புரத மடிப்பு நிகழ்வு என்பது பெருமளவில் ஒரு பரிசோதனை முயற்சியாகவே இருந்தது. இந்த அணுகுமுறையானது குறைந்த செயல் படுத்த முடியாமை கொள்கையை அறிமுகம் செய்தது, இது இயற்கைப் புரதங்களின் அமினோ அமில வரிசைகளை கூர்ப்பு தேர்ந்தெடுத்துள்ளதை இது உறுதிப்படுத்தும், ஆகவே பக்கச் சங்கிலிகளுக்கு இடையான இடவினைகள் மடிந்த நிலை மூலக்கூறின் கையகப்படுத்தலுக்கு பெருமளவில் உதவுகிறது. எஞ்சிய சில செயல் படுத்த முடியாமை இருக்குமென எதிர்பார்க்கப்படும்போதும், மடிப்புக்கு ஆதரவாக அமையாத இடைவினைகள் எதிராக தேர்ந்தெடுக்கப்படும். புரதங்கள், இயல்பான நிலைக்கு பெருமளவில் வழிப்படுத்தப்படும் உலகளாவிய "புனல்வடிவமான சக்தி இயற்கைத்தோற்றங்களைக்" கொண்டிருக்க வேண்டுமென (ஜோஸ் ஓனுசிக் உருவாக்கியது[reference needed]) பொதுவாகக் கருதப்படுவது கூர்ப்பு ரீதியாகத் தேர்ந்தெடுக்கப்பட்ட இந்த வரிசைகளின் பின்விளைவாகும். இந்த "மடிப்புப் புனல்" இயற்கைத் தோற்றமானது, புரதத்தை ஒரு தனித்த பொறிமுறைக்கு மட்டும் மட்டுப்படுத்தாமல் எந்தவொரு பெரிய எண்ணிக்கையான பாதைகள் மற்றும் இடைநிலைகளூடாக இயல்பான நிலைக்கு மடிய அனுமதிக்கும். கோட்பாட்டை மாதிரி புரதங்களின் கணிப்பியல் பாவனைகள் மற்றும் பல்வேறு பரிசோதனை ஆய்வுகள் இரண்டும் ஆதரிக்கிறது, மேலும் புரத வடிவமைப்பு எதிர்வுகூறல் மற்றும் வடிவமைப்பு ஆகியவற்றுக்கான செயன்முறைகளை மேம்படுத்தப் பயன்பட்டுள்ளது [reference needed]. கட்டற்ற-சக்தி இயற்கைத்தோற்றத்தை சமநிலைப்படுத்துவதன் மூலமான புரத மடிப்பின் விவரமும் 2வது வெப்ப இயக்கவியல் விதிக்கு இசைவானது.[23]
புரத மடிப்பை ஆராய்வதற்கான தொழில்நுட்பங்கள்
தொகுவட்டமான இரு வண்ணத் தன்மை
தொகுவட்டமான இரு வண்ணத் தன்மை என்பது புரத மடிப்பை ஆராய்வதற்கு மிகவும் பொதுவான மற்றும் அடிப்படைக் கருவியாகும். வட்டமான இரு வண்ணத் தன்மை நிறமாலைகாட்டியியல் ஆனது வட்டமாக முனைவாக்கிய ஒளியை அளக்கிறது. புரதங்களில், ஆல்பா சுருள்கள் மற்றும் பீட்டா தாள்கள் போன்ற வடிவமைப்புகள் கிரல் (chiral) ஆகும், ஆகவே அதுபோன்ற ஒளியை அகத்துறிஞ்சும். இந்த ஒளியை அகத்துறிஞ்சுவதானது புரத குழும மடிப்புத்தன்மையின் பாகையைக் குறிக்கும் கருவியாக செயல்படும். செயலிழக்கச் செய்கின்ற பொருளின் செறிவு அல்லது வெப்பநிலையின் சார்பாக, இந்த அகத்துறிஞ்சலிலுள்ள மாற்றத்தை அளவிடுவதன்மூலம் புரதத்தின் சமநிலை மடியாமையை அளக்க இந்த தொழில்நுட்பத்தைப் பயன்படுத்தலாம். செயலிழக்கச் செய்கின்ற பொருள் உருகுவதானது மடியாமையின் கட்டற்ற சக்தி மற்றும் அதோடு புரத m ம்திப்பு, அல்லது செயலிழக்கச் செய்கின்ற பொருள் சார்புள்ளமை ஆகியவற்றை அளக்கிறது. வெப்பநிலை உருகுவதானது புரதத்தின் உருகும் வெப்பநிலையை (Tm) அளக்கும். இந்த வகையான நிறமாலைகாட்டியியலானது புரத மடிப்பு 0}இயக்கவியலை அளக்கவும் செவ்ரான் பகுதிகளை உருவாக்கவும், நிறுத்தப்பட்ட ஓட்டம் போன்ற வேகமாக-கலக்கும் சாதனங்களுடனும் இணையக்கூடியது.
புரதங்களின் அதிர்வுக்குரிய வட்டமான இரு வண்ணத் தன்மை
தொகுதற்போது ஃபோரியர் மாற்ற (FFT) உபகரணங்களில் ஈடுபடுத்துகின்ற புரதங்களுக்காக மிக அண்மையில் விருத்திசெய்யப்பட்ட அதிர்வுக்குரிய வட்டமான இரு வண்ணத் தன்மை (VCD) தொழில்நுட்பங்கள், மிகப்பெரிய புரத மூலக்கூறுகளாக இருந்தாலும் கூட, கரைசலிலுள்ள புரதக் கட்டமைப்புகளைத் தீர்மானிப்பதற்கான திறன்வாய்ந்த வழிகளை வழங்குகின்றன. புரதங்களின் இதுபோன்ற VCD ஆய்வுகள் CD இலிருந்து பெறமுடியாத தெளிவான அமைப்பிற்குரிய நிர்ணயங்களை வழங்க, பெரும்பாலும் புரத பளிங்குகளின் X-கதிர் சிதறல், கனமான நீரில் (D2O) புரத கரைசல்களுக்கான FT-IR தரவு அல்லது தொடக்கத்திலிருந்தே பங்கு கணிப்புகளுடன் இணைக்கப்படுகின்றன.
அதிக நேர நுணுக்கத்துடனான நவீன ஆய்வுகள்
தொகுபுரத மடிப்பு ஆய்வானது அண்மைக்காலத்தில், வேகமான, நேர-உறுதியான தொழில்நுட்பங்களால் சிறப்பாக மேம்பட்டுள்ளது. இவை மடிக்காத புரத மாதிரியின் மடிப்பை விரைவக தொடக்குவதற்கும், இதன் விளைவாக வரும் இயக்கவியலை அவதானிப்பதற்குமான பரிசோதனை முறைகளாகும். பரந்துபட்ட பயன்பாட்டிலுள்ள விரைவான தொழில்நுட்பங்கள் நியூத்திரன் சிதறல்[24], கரைசலின் அதிவிரைவு கலத்தல், ஒளி வேதிம முறைகள் மற்றும் லேசர் வெப்பநிலை தாவல் நிறமாலைகாட்டியியல் ஆகியவறை உள்ளடக்கும். இந்த தொழில்நுட்பங்களின் உருவாக்கத்தில் பங்களித்த பல விஞ்ஞானிகளுள் ஜெரெமி கூக், ஹெய்ன்ரிச் ரோடர், ஹாரி கிரே, மார்டின் குருவெபெல், பிரியான் டையர், வில்லியம் ஈட்டன், ஷீனா ராட்ஃபோர்ட், கிரிஸ் டாப்சன், சர் அலன் ஆர். ஃபெர்ஷ்ட் மற்றும் பெங்ட் நால்டிங் ஆகியோர் அடங்குவர்.
புரதம் மூன்றாம் நிலை வடிவமைப்பின் கணிப்பு எதிர்வுகூறல்
தொகுபுதிதாக அல்லது தொடக்கத்திலிருந்தே கணிப்பு புரத வடிவமைப்பு எதிர்வுகூறலுக்கான தொழில்நுட்பங்கள் புரத மடிப்புக் குறித்த ஆய்வுகளுடன் தொடர்பானவை,ஆனால் கண்டிப்பாக முற்றாக மாறுபட்டவை. மூலக்கூற்று இயக்கவியல் (MD) என்பது சிலிக்கோவில் புரத மடிப்பு மற்றும் இயக்கவியல் ஆய்வுக்கு முக்கியமான ஒரு கருவியாகும். கணிப்புச் செலவு காரணமாக, தொடக்கத்திலிருந்தே தெளிவான நீருடனான MD மடிப்பு பாவனைகள் பெப்தைட்டுகளுக்கும் மிகவும் சிறிய புரதங்களுக்கும்[25][26] மட்டுப்படுத்தப்பட்டுள்ளன. பெரிய புரதங்களின் MD பாவனைகள் பரிசோதனைக்குரிய வடிவமைப்பின் இயக்கவியல் அல்லது இதன் உயர்-வெப்பநிலை மடியாமைக்கு மட்டுப்படுத்தப்பட்டதாகவே தொடர்ந்தும் இருக்கும். சிறிய அளவான (சுமார் 50 எச்சங்கள்) அல்லது பெரிய புரதங்களை மடித்தல் போன்ற நீண்ட நேர செயலாக்கங்களை போலியாகச் செய்வதன் பொருட்டு (சுமார் 1 மைக்ரோவினாடிக்கு அப்பால்) புரத மாதிரிகளில் சில தோராயங்கள் அல்லது எளிமைப்படுத்துதல்களை அறிமுகம் செய்யவேண்டும். தாழ்த்தப்பட்ட புரத பிரதிநிதித்துவத்தையும் (அணுக்களைக் கொண்ட குழுக்களைப் பிரதிநிதித்துவம் செய்யும் பொய்யான-அணுக்கள் வரையறுக்கப்பட்டுள்ளன) மற்றும் புள்ளிவிவரவியல் வளத்தையும் பயன்படுத்தும் அணுகுமுறையனது புரத வடிவமைப்பு எதிர்வுகூறுதலில் மட்டும் பயனுள்ளதாக அன்றி, மடிப்பு வழிமுறைகளைப் பெருக்கும் திறனும் உள்ளது.[27]
புரத மடிப்பு அல்லது புரத வடிவமைப்பை எதிர்வுகூறுதல் போன்ற சிக்கல்களைத் தீர்க்க தனிப்பட்ட கணினிகளின் செயல்படாமலுள்ள CPU அல்லது GPU நேரத்தைப் பயன்படுத்தும் கணக்கிடுகின்ற பணித்திட்டங்கள் உள்ளன.. இந்த பணித்திட்டங்களுக்கு ஆதரவு தெரிவிக்க மக்கள் இவற்றை அவர்களின் கணினியில் அல்லது PlayStation 3 இல் இயக்கலாம். இந்த பணித்திட்டங்களில் எவ்வாறு பங்கெடுப்பது என்பது பற்றிய தகவலைப் பெற கீழேயுள்ள இணைப்புகளை (எடுத்துக்காட்டாக Folding@Home) பார்க்கவும்.
புரத வடிவமைப்பு தீர்மானத்தின் பரிசோதனைரீதியான தொழில்நுட்பங்கள்
தொகுபுரதங்களின் மடிக்கப்பட்ட வடிவமைப்புகளை வழக்கமாக X-கதிர் படிகவியல் மற்றும் NMR ஆகியன தீர்மானிக்கின்றன.
மேலும் காண்க
தொகு- Anfinsen's dogma
- Harvard-MIT Scientists Discover the Protein Folding Code and demonstrate this is a Network phenomenon
- Chevron plot
- Denaturation (biochemistry)
- Denaturation midpoint
- Downhill folding
- Folding (chemistry)
- Folding@Home
- Foldit computer game
- Levinthal paradox
- Protein design
- Protein dynamics
- Protein Misfolding Cyclic Amplification
- Protein structure prediction
- Protein structure prediction software
- Rosetta@home
- Software for molecular mechanics modeling
குறிப்புதவிகள்
தொகு- ↑ Alberts, Bruce (2002). "The Shape and Structure of Proteins". Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. பன்னாட்டுத் தரப்புத்தக எண் 0-8153-3218-1.
{{cite book}}: Unknown parameter|chapterurl=ignored (help); Unknown parameter|coauthors=ignored (help) - ↑ Anfinsen, C. (1972). "The formation and stabilization of protein structure". Biochem. J. 128 (4): 737–49. பப்மெட்:4565129. https://archive.org/details/sim_biochemical-journal_1972-07_128_4/page/737.
- ↑
Jeremy M. Berg, John L. Tymoczko, Lubert Stryer; Web content by Neil D. Clarke (2002). "3. Protein Structure and Function". Biochemistry. San Francisco: W. H. Freeman. பன்னாட்டுத் தரப்புத்தக எண் 0-7167-4684-0.
{{cite book}}: Unknown parameter|chapterurl=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ 4.0 4.1 Dennis J. Selkoe (2003). "Folding proteins in fatal ways". Nature 426: pp. 900–904. doi:10.1038/nature02264. பப்மெட்:14685251. http://www.nature.com/nature/journal/v426/n6968/full/nature02264.html.
- ↑ van den Berg, B., Wain, R., Dobson, C. M., Ellis R. J. (August 2000). "Macromolecular crowding perturbs protein refolding kinetics: implications for folding inside the cell". EMBO J. 19 (15): 3870–5. doi:10.1093/emboj/19.15.3870. பப்மெட்:10921869.
- ↑ Pace, C., Shirley, B., McNutt, M., Gajiwala, K. (1 January 1996). "Forces contributing to the conformational stability of proteins". FASEB J. 10 (1): 75–83. பப்மெட்:8566551. http://www.fasebj.org/cgi/reprint/10/1/75.
- ↑ Rose, G., Fleming, P., Banavar, J., Maritan, A. (2006). "A backbone-based theory of protein folding". Proc. Natl. Acad. Sci. U.S.A. 103 (45): 16623–33. doi:10.1073/pnas.0606843103. பப்மெட்:17075053.
- ↑ Deechongkit, S., Nguyen, H., Dawson, P. E., Gruebele, M., Kelly, J. W. (2004). "Context Dependent Contributions of Backbone H-Bonding to β-Sheet Folding Energetics". Nature 403 (45): 101–5. doi:10.1073/pnas.0606843103. பப்மெட்:17075053.
- ↑ Anfinsen CB. (20 July 1973). "Principles that Govern the Folding of Protein Chains". Science. 181 (4096): 223-230. doi:10.1126/science.181.4096.223. http://www.sciencemag.org/cgi/pdf_extract/181/4096/223. பார்த்த நாள்: 21 ஜூலை 2010.
- ↑ Govindarajan S, Recabarren R, Goldstein RA. (17 Sep 1999). "Estimating the total number of protein folds.". Proteins. 35 (4): 408-414. http://www3.interscience.wiley.com/journal/65000323/abstract. பார்த்த நாள்: 21 ஜூலை 2010.
- ↑ Mirny, L. A., Abkevich, V. I. & Shakhnovich, E. I. (28 Apr 1998). "How evolution makes proteins fold quickly.". Proc Natl Acad Sci U S A. 95 (9): 4976-4981. http://www.pnas.org/content/95/9/4976.abstract.[தொடர்பிழந்த இணைப்பு]
- ↑ S Rackovsky. (15 Jan 1993). "On the nature of the protein folding code.". Proc Natl Acad Sci U S A. 90 (2): 644-648. http://www.pnas.org/content/90/2/644.abstract.[தொடர்பிழந்த இணைப்பு]
- ↑ Venkataramanan Soundararajan, Rahul Raman, S. Raguram, V. Sasisekharan, Ram Sasisekharan (2010). "Atomic Interaction Networks in the Core of Protein Domains and Their Native Folds". PLoS ONE 5 (2): e9391. doi:10.1371/journal.pone.0009391.
- ↑ Lee, S., Tsai, F. (2005). "Molecular chaperones in protein quality control". J. Biochem. Mol. Biol. 38 (3): 259–65. பப்மெட்:15943899. http://www.jbmb.or.kr/fulltext/jbmb/view.php?vol=38&page=259. பார்த்த நாள்: 2010-07-21.
- ↑ Alexander, P. A., He Y., Chen, Y., Orban, J., Bryan, P. N. (2007). "The design and characterization of two proteins with 88% sequence identity but different structure and function". Proc Natl Acad Sci U S A. 104 (29): 11963–8. doi:10.1073/pnas.0700922104. பப்மெட்:17609385.
- ↑ Takai, K., Nakamura, K., Toki, T., Tsunogai, U., Miyazaki, M., Miyazaki, J., Hirayama, H., Nakagawa, S., Nunoura, T., Horikoshi, K. (2008). "Cell proliferation at 122 °C and isotopically heavy CH4 production by a hyperthermophilic methanogen under high-pressure cultivation". Proc Natl Acad Sci USA 105: 10949–54. doi:10.1073/pnas.0712334105.
- ↑ Shortle, D. (1 January 1996). "The denatured state (the other half of the folding equation) and its role in protein stability". FASEB J. 10 (1): 27–34. பப்மெட்:8566543. http://www.fasebj.org/cgi/reprint/10/1/27.
- ↑ எஆசு:10.1146/annurev.biochem.75.101304.123901
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ C. Levinthal (1968). "Are there pathways for protein folding?". J. Chim. Phys. 65: 44–5. http://www.biochem.wisc.edu/courses/biochem704/Reading/Levinthal1968.pdf. பார்த்த நாள்: 2010-07-21.
- ↑ Kim, P. S., Baldwin, R. L. (1990). "Intermediates in the folding reactions of small proteins". Annu. Rev. Biochem. 59: 631–60. doi:10.1146/annurev.bi.59.070190.003215. பப்மெட்:2197986. https://archive.org/details/sim_annual-review-of-biochemistry_1990_59/page/631.
- ↑ Jackson S. E. (August 1998). "How do small single-domain proteins fold?" ([தொடர்பிழந்த இணைப்பு]). Fold Des 3 (4): R81–91. doi:10.1016/S1359-0278(98)00033-9. பப்மெட்:9710577. http://biomednet.com/elecref/13590278003R0081.
- ↑ Kubelka, J., Hofrichter, J., Eaton, W. A. (February 2004). "The protein folding 'speed limit'". Curr. Opin. Struct. Biol. 14 (1): 76–88. doi:10.1016/j.sbi.2004.01.013. பப்மெட்:15102453.
- ↑ Sharma, V., Kaila, V. R. I., and Annila, A. (2009). "Protein folding as an evolutionary process". Physica A 388 (6): 851–862. doi:10.1016/j.physa.2008.12.004.
- ↑ Bu, Z; Cook, J; Callaway, D. J. E. (2001). "Dynamic regimes and correlated structural dynamics in native and denatured alpha-lactalbuminC". J Mol Biol 312 (4): 865–873. doi:10.1006/jmbi.2001.5006. பப்மெட்:11575938.
- ↑ "Fragment-based Protein Folding Simulations".
- ↑ "Protein folding" (by Molecular Dynamics).
- ↑ Kmiecik, S., and Kolinski, A. (2007). "Characterization of protein-folding pathways by reduced-space modeling". Proc. Natl. Acad. Sci. U.S.A. 104 (30): 12330–5. doi:10.1073/pnas.0702265104. பப்மெட்:17636132.
வெளிப்புற இணைப்புகள்
தொகு- FoldIt - ஃபோல்டிங் புரோட்டின் கேம் பரணிடப்பட்டது 2021-01-04 at the வந்தவழி இயந்திரம்
- Folding@Home பரணிடப்பட்டது 2008-06-16 at the வந்தவழி இயந்திரம்
- Rosetta@Home
வார்ப்புரு:Protein tertiary structure வார்ப்புரு:Protein topics