பேரியம் அயோடைடு
பேரியம் அயோடைடு ( Barium iodide) BaI2 என்ற மூலக்கூறு வாய்பாடு கொண்டுள்ள ஒரு கனிம சேர்மமாகும். இச்சேர்மம் நீரிலி மற்றும் நீரேறி என்ற இரு நிலைகளில் காணப்படுகின்றது. இவ்விரு நிலைகளிலும் இது வெண்மை நிற திடப்பொருளாகக் காணப்படுகிறது. பேரியம் அயோடைடு நிரேறியை சூடாக்கும் போது இது பேரியம் அயோடைடு நீரிலி உப்பாக மாற்றப்படுகிறது. நிரேறி நிலையில் இவ்வுப்பு எளிதாக நீர், எத்தனால், அசெட்டோன் போன்ற கரைப்பான்களில் கரைகிறது.
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
Barium iodide
| |
| வேறு பெயர்கள்
Barium iodide, anhydrous
| |
| இனங்காட்டிகள் | |
| 13718-50-8 | |
| ChemSpider | 75507 |
| EC number | 237-276-9 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 83684 |
| |
| பண்புகள் | |
| BaI2 (anhydrous) BaI2·2H2O (dihydrate) | |
| வாய்ப்பாட்டு எடை | 391.136 g/mol (anhydrous) 427.167 g/mol (dihydrate) |
| தோற்றம் | White orthorhombic crystals (anhydrous) colorless crystals (dihydrate) |
| மணம் | odorless |
| அடர்த்தி | 5.15 g/cm3 (anhydrous) 4.916 g/cm3 (dihydrate) |
| உருகுநிலை | 711 °C (1,312 °F; 984 K) |
| 166.7 g/100 mL (0 °C) 221 g/100 mL (20 °C) 246.6 g/100 mL (70 °C) | |
| கரைதிறன் | soluble in ethanol, acetone |
| கட்டமைப்பு | |
| படிக அமைப்பு | Orthorhombic, oP12, SpaceGroup = Pnma, No. 62 |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-602.1 kJ·mol-1 |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | toxic |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | barium fluoride barium chloride barium bromide |
| ஏனைய நேர் மின்அயனிகள் | beryllium iodide magnesium iodide calcium iodide strontium iodide |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
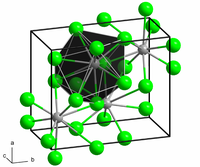
அமைப்பு
தொகுபேரியம் அயோடைடின் நீரற்ற வடிவ அமைப்பு காரீய டை குளோரைடின் வடிவ அமைப்பை ஒத்துள்ளது. ஒவ்வொரு பேரிய மையமும் ஒன்பது அயோடைடு ஈந்தணைவிகளுடன் பிணைக்கப்பட்டுள்ளது[2] . பேரியம் குளோரைடு போன்றே படிகநிரப்பி அமைப்புடன் காணப்படுகிறது[3].
வினைகள்
தொகுபேரியத்தை ஈத்தருடன் கூடிய 1,2 ஈரையோடோஈத்தேன் உடன் சேர்த்து வினைப்படுத்தினால் நீரற்ற பேரியம் அயோடைடு தாயாரிக்க இயலும்[4].
பேரிய அயோடைடு ஆல்கைல் பொட்டாசியம் சேர்மங்களுடன் சேர்ந்து கரிமபேரியம் சேர்மங்களைக் கொடுக்கிறது[5].
பைபீனைலுடன் சேர்த்து பேரியம் அயோடைடை குறைத்தல் வினைக்கு உட்படுத்தும்போது அதிக செயல்திறம் மிக்க பேரியம் உருவாகிறது[6].
முன்பாதுகாப்பு
தொகுமற்ற பேரியம் உப்புகளைப் போன்றே பேரியம் அயோடைடும் நச்சுத்தன்மை கொண்ட உப்பு ஆகும்.
மேற்கோள்கள்
தொகு- ↑ Lide, David R. (1998), Handbook of Chemistry and Physics (87 ed.), Boca Raton, FL: CRC Press, pp. 4–44, பன்னாட்டுத் தரப்புத்தக எண் 0-8493-0594-2
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. பன்னாட்டுத் தரப்புத்தக எண் 0-19-855370-6.
- ↑ Brackett, E. B.; Brackett, T. E.; Sass, R. L.; The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide. J. Phys. Chem., 1963, volume 67, 2132 – 2135
- ↑ Duval, E.; Zoltobroda, G.; Langlois, Y.; A new preparation of BaI2: application to (Z)-enol ether synthesis. Tetrahedron Letters, 2000, 41, 337-339
- ↑ Walter, M. D.; Wolmershauser, G.; Sitzmann, H.; Calcium, Strontium, Barium, and Ytterbium Complexes with Cyclooctatetraenyl or Cyclononatetraenyl Ligands. J. Am. Chem. Soc., 2005, 127 (49), 17494 – 17503.
- ↑ Yanagisawa, A.; Habaue, S.; Yasue, K.; Yamamoto, H.; Allylbarium Reagents: Unprecedented Regio- and Stereoselective Allylation Reactions of Carbonyl Compounds. J. Am. Chem. Soc.1994, 116,6130-6141