பொட்டாசியம் சல்பைடு
பொட்டாசியம் சல்பைடு (Potassium sulfide) என்பது K2S. என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். நிறமற்ற இத்திண்மம் அரிதாக கிடைக்கிறது. தண்ணீருடன் பொட்டாசியம் சல்பைடு வினைபுரிந்து பொட்டாசியம் ஐதரோசல்பைடு மற்றும் பொட்டாசியம் ஐதராக்சைடுகளை உருவாக்குகிறது. பொதுவாக பொட்டாசியம் சல்பைடு என்று அழைக்கப்பட்டாலும் இது ஒரு நீரற்ற திண்மம் அல்ல மேற்கண்ட இரண்டு சேர்மங்களின் கலவை ஆகும்.
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
பொட்டாசியம் சல்பைடு
| |
| வேறு பெயர்கள்
Dipotassium monosulfide,
Dipotassium sulfide, Potassium monosulfide, Potassium sulfide | |
| இனங்காட்டிகள் | |
| 1312-73-8 | |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| வே.ந.வி.ப எண் | TT6000000 |
| |
| பண்புகள் | |
| K2S | |
| வாய்ப்பாட்டு எடை | 110.262 கி/மோல் |
| தோற்றம் | தூய்மை: நிறமற்றது மாசு: மஞ்சள்-பழுப்பு |
| மணம் | HS |
| அடர்த்தி | 1.74 கி/செ.மீ3 |
| உருகுநிலை | 840 °C (1,540 °F; 1,110 K) |
| கொதிநிலை | 912 °C (1,674 °F; 1,185 K) (சிதைவடையும்) |
| KSH, KOH ஆக மாறுகிறது. | |
| பிற கரைப்பான்கள்-இல் கரைதிறன் | எத்தனால், கிளிசரால் ஆகியன்வற்றில் கரையும். ஈதரில் கரையாது |
| கட்டமைப்பு | |
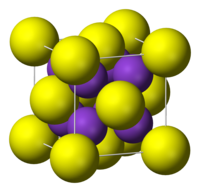
| படிக அமைப்பு | புளோரைட்டு எதிர் அமைப்பு |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | சுற்றுச்சூழலுக்கு அபாயமானது (N) |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய நேர் மின்அயனிகள் | சோடியம் சல்பைடு, இரும்பு(II) சல்பைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
அமைப்பு
தொகுபுளோரைட்டின் எதிர் அமைப்பை பொட்டாசியம் சல்பைடு பெற்றுள்ளது. அதாவது புளோரைட்டில் உள்ள நான்முக (F−) தளங்களில் சிறிய பொட்டாசியம் (K+) அயனிகள் ஆக்ரமித்துள்ளன. பெரிய (S2−) மையங்கள் எட்டு ஒருங்கிணைவுத் தளங்களில் ஆக்ரமித்துள்ளன. Li2S, Na2S, மற்றும் Rb2S போன்ற சேர்மங்கள் பொட்டாசியம் சல்பைடு போலவே படிகமாகின்றன.[1]
தயாரிப்பு மற்றும் வினைகள்
தொகுK2SO4 உடன் கல்கரியைச் சேர்த்து சூடாக்குவதன் மூலமாக பொட்டாசியம் சல்பைடைத் தயாரிக்கலாம்.:
- K2SO4 + 4 C → K2S + 4 CO
நீரற்ற அமோனியாவில் பொட்டாசியத்துடன் கந்தகத்தைச் சேர்த்து வினைபுரியச் செய்வதன் மூலம் ஆய்வகங்களில் பொட்டாசியம் சல்பைடு தயாரிக்கப்படுகிறது.[2]
சல்பைடு ஒர் உயர் காரமாகும். ஆதலால் பொட்டாசியம் சல்பைடு முழுமையாகவும் திரும்ப மீட்சியடையாமலும் நீராற்பகுப்பு அடைகிறது.
- K2S + H2O → KOH + KSH
பல செயல்முறைகளுக்கு இவ்வினை முரணாகவும் தொடர்ச்சியற்றும் காணப்படுகிறது. SH− மற்றும் OH− அயனிகளின் கலவை S2− அயனிகளின் மூலமாகச் செயல்படுகிறது. மற்ற கார உலோகங்களின் சல்பைடுகளும் இவ்வாறே செயல்படுகின்றன என்பது கவனிக்கத்தக்கது ஆகும்.[1]
வானவெடிகளில் பயன்
தொகுதாழ்தர வெடிபொருள்கள் வெடிக்கும் பொழுது பொட்டாசியம் சல்பைடு உருவாகிறது. இவ்விடைநிலை சேர்மம் பட்டாசுத் தொழிலில் பல பயன்களை அளிக்கின்றது.[3]
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
- ↑ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 360.
- ↑ Shimizu, Takeo. "Fireworks: the Art, Science, and Technique." Pyrotechnica Publications: Austin, 1981. பன்னாட்டுத் தரப்புத்தக எண் 0-929388-05-4.