அயோடின் ஐந்தாக்சைடு
அயோடின் ஐந்தாக்சைடு (Iodine pentoxide) என்பது I2O5 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு வேதிச் சேர்மம் ஆகும். அயோடிக் அமிலத்தின் நிலைப்புத் தன்மையுடைய ஒரேயொரு நீரற்ற வடிவச் சேர்மம் அயோடின் ஐந்தாக்சைடு ஆகும். 0 செல்சியசு வெப்பநிலையில் அயோடிக் அமிலத்தை உலர் காற்றில் நீர்நீக்கம் செய்வதால் அயோடின் ஐந்தாக்சைடு தயாரிக்கலாம்:[1]
| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
டை அயோடின் பென்டாக்சைடு
| |
| வேறு பெயர்கள்
அயோடின்(V) ஆக்சைடு
அயோடிக் நீரிலி | |
| இனங்காட்டிகள் | |
| 12029-98-0 | |
| ChEBI | CHEBI:29914 |
| ChemSpider | 140179 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 159402 |
| |
| பண்புகள் | |
| I 2O 5 | |
| வாய்ப்பாட்டு எடை | 333.81 கி/மோல் |
| தோற்றம் | வெண்மையான படிகத் திடப்பொருள்[1] hygroscopic |
| அடர்த்தி | 4.980 கி/செ.மீ3[1] |
| உருகுநிலை | 300 °C (572 °F; 573 K)[2] (சிதைவடையும்) |
| கரைதிறன் | நைட்ரிக் அமிலத்தில் கரையும்; எத்தனால், ஈதர் மற்றும் CS2 ஆகியவற்றில் கரையாது. |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிசனேற்றி |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | அயோடின் ஐம்புளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
- 2HIO3 → I2O5 + H2O
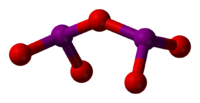
அமைப்பு
தொகு139.2° கோண அளவுடன் வளைந்த I-O-I பிணைப்புடன் அயோடின் ஐந்தாக்சைடு காணப்படுகிறது. ஆடித்தளம் இல்லாத மூலக்கூறு என்பதால் இதனுடைய சீரொழுங்கு C2v. ஆக இருப்பதில்லை. விளிம்புநிலை பிணைப்புகளில் I-O இடைவெளி 1.80 Å ஆகவும் பாலம் அமைக்கும் பிணைப்புகளில் இந்நீளம் 1.95 Å ஆகவும் காணப்படுகிறது[3]
வினைகள்
தொகுஅயோடின் ஐந்தாக்சைடு , அறை வெப்பநிலையில் கார்பன் ஓராக்சைடை எளிதாக கார்பன் டை ஆக்சைடாக ஆக்சிசனேற்றம் செய்கிறது.
- 5CO + I2O5 → I2 + 5CO2
வளிம மாதிரிகளில் உள்ள கார்பன் ஓராக்சைடின் அடர்த்தியை பகுப்பாய்வு செய்வதற்கு இவ்வினை பயன்படுத்தப்படுகிறது.
அயோடின் ஐந்தாக்சைடு SO3 மற்றும் S2O6F2 ஆகியனவற்றுடன் இணைந்து அயோடைல் உப்புகளையும் கந்தக அமிலத்துடன் சேர்ந்து அயோடோசில் உப்புகளையும் தருகிறது.
சுமார் 350 0 செல்சியசு வெப்பநிலைக்குச் சூடுபடுத்தினால் அயோடின் ஐந்தாக்சைடு அயோடின் ஆவியாகவும் ஆக்சிசனாகவும் சிதைவடைகிறது[4]
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 1.2 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 851–852. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ Patnaik, P. (2002). Handbook of Inorganic Chemicals. McGraw-Hill. பன்னாட்டுத் தரப்புத்தக எண் 0-07-049439-8.
- ↑ Selte, K.; Kjekshus, A. (1970). "Iodine Oxides: Part III. The Crystal Structure of I2O5" (pdf). Acta Chemica Scandinavica 24 (6): 1912–1924. doi:10.3891/acta.chem.scand.24-1912. http://actachemscand.org/pdf/acta_vol_24_p1912-1924.pdf.
- ↑ G. Baxter and G. Tilley, "A Revision of the Atomic Weights of Iodine and Silver," The Chemical News and Journal of Industrial Science; Volumes 99-100, Royal Society Anniversary Meeting, December 3, 1909, p. 276. (Google Books)