அயோடின் ஐம்புளோரைடு
அயோடின் ஐம்புளோரைடு (Iodine pentafluoride) என்பது IF5 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு இடை உப்பீனி வேதிச் சேர்மம் ஆகும். மஞ்சள் அல்லது நிறமற்ற நிலைகளில் காணப்படும் அயோடினின் புளோரைடான இச்சேர்மம், 3.250 கி.செ.மீ −3 அடர்த்தியுடைய திரவமாகக் காணப்படுகிறது. என்றி மோயிசான் 1891 ஆம் ஆண்டில் முதன் முதலில் அயோடின் ஐம்புளோரைடைத் தொகுப்பு முறையில் தயாரித்தார். புளோரின் வாயுவில் அயோடின் எரிக்கப்படும்[4] இத்தொகுப்பு முறை ஒரு வெப்ப உமிழ் வினையாகும். அயோடின் ஐம்புளோரைடைத் தயாரிப்பதற்கு இத்தயாரிப்பு முறையே சற்று மேம்படுத்தப்பட்டு இன்று வரையில் பின்பற்றப்படுகிறது[5][6]
| |||
| பெயர்கள் | |||
|---|---|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
Iodine(V) fluoride | |||
| முறையான ஐயூபிஏசி பெயர்
ஐம்புளோரோ-λ5-அயோடேன் | |||
| வேறு பெயர்கள்
அயோடிக் புளோரைடு
| |||
| இனங்காட்டிகள் | |||
| 7783-66-6 | |||
| ChemSpider | 455940 | ||
| EC number | 232-019-7 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 522683 | ||
| |||
| பண்புகள் | |||
| IF5 | |||
| வாய்ப்பாட்டு எடை | 221.89 கி/மோல் | ||
| தோற்றம் | நிறமற்றது அல்லது வெளிர் மஞ்சள் நீர்மம் | ||
| அடர்த்தி | 3.250 கி/செ.மீ3 | ||
| உருகுநிலை | 9.43 °C (48.97 °F; 282.58 K) | ||
| கொதிநிலை | 97.85 °C (208.13 °F; 371.00 K) | ||
| வினைபுரியும்[1] | |||
| கட்டமைப்பு | |||
| படிக அமைப்பு | ஒற்றைச்சரிவு புள்ளித் தொகுதி C2/c | ||
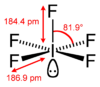
| ஒருங்கிணைவு வடிவியல் |
சதுரப் பட்டகம் | ||
| மூலக்கூறு வடிவம் | |||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | நச்சு, ஆக்சிசனேற்றி, அரிப்புத்தன்மை உடையது. | ||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | External MSDS | ||
| GHS pictograms |    
| ||
| GHS signal word | அபாயம் | ||
| H271, H330, H311, H301, H314, H371, H410[3] | |||
| P202, P232, P304, P310[3] | |||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | அயோடின் ஐந்தாக்சைடு | ||
| ஏனைய நேர் மின்அயனிகள் | புரோமின் ஐம்புளோரைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
- I2 + 5 F2 → 2 IF5
வேதியியல்
தொகுஅயோடின் ஐம்புளோரைடு ஒரு வலிமையான புளோரினேற்றியாகவும் உயர் ஆக்சிசனேற்றச் சேர்மமாகவும் விளங்குகிறது. தண்ணீருடன் தீவிரமாக வினைபுரிந்து ஐதரோ புளோரிக் அமிலத்தையும் அதிக அளவு புளோரினுடன் இணைந்து [[அயோடின் எழுபுளோரைடு அல்லது அயோடின் எப்டா புளோரைடையும் உருவாக்குகிறது.
முதனிலை அமீன்கள் அயோடின் ஐம்புளோரைடன் வினைபுரியும் போது நீருடனான நீராற்பகுத்தல் வினைக்கு உட்பட்டு நைட்ரைல்களை உருவாக்குகிறது[7]
- R-CH2-NH2 → R-CN
மேற்கோள்கள்
தொகு- ↑ Patnaik, P. (2002). Handbook of Inorganic Chemicals. McGraw-Hill. பன்னாட்டுத் தரப்புத்தக எண் 0-07-049439-8.
- ↑ Durbank, R. D.; Jones, G. R. (1974). "Crystal structure of Iodine Pentafluoride at -80° ". Inorganic Chemistry 13 (5): 421–439. doi:10.1021/ic50135a012.
- ↑ 3.0 3.1 http://www.chemadvisor.com/Matheson/database/msds/mat11440000800003.PDF
- ↑ Moissan, M. H. (1891). "Nouvelles Recherches sur le Fluor". Annales de Chimie et de Physique 6 (24): 224–282. http://gallica.bnf.fr/ark:/12148/bpt6k34894x/f222.tableDesMatieres.
- ↑ Otto Ruff; Keim, R. (1930). "Das Jod-7-fluorid [The iodine-7-fluoride]" (in German). Zeitschrift für Anorganische und Allgemeine Chemie 193 (1): 176–186. doi:10.1002/zaac.19301930117.
- ↑ Ruff O.; Keim R. (1931). "Fluorierung von Verbindungen des Kohlenstoffs (Benzol und Tetrachlormethan mit Jod-5-fluorid, sowie Tetrachlormethan mit Fluor) [Fluoridation of Carbon Compounds (Benzene and Tetrachlormethane with Iodine-5-Fluoride, and Tetrachloromethane with Fluorine)]" (in German). Zeitschrift für Anorganische und Allgemeine Chemie 201 (1): 245–258. doi:10.1002/zaac.19312010122.
- ↑ Stevens, T. E. (1966). "Rearrangement of Amides with Iodine Pentafluoride". Journal of Organic Chemistry 31 (6): 2025–2026. doi:10.1021/jo01344a539.
உசாத்துணை
தொகு- Lord, R. C.; Lynch, M. A.; Schumb, W. C.; Slowinski, E. J. (1950). "The Vibrational Spectra and Structures of Iodine Pentafluoride and Heptafluoride". Journal of the American Chemical Society 72 (1): 522–527. doi:10.1021/ja01157a135.
- Rogers, M. T.; Speirs, J. L.; Thompson, H. B.; Panish, M. B. (1954). "Iodine Pentafluoride, Freezing and Boiling Point, Heat of Vaporization and Vapor Pressure-Temperature Relations". Journal of the American Chemical Society 76 (19): 4843–4844. doi:10.1021/ja01648a022.
- Rogers, M. T.; Thompson, H. B.; Speirs, J. L. (1954). "Dielectric Constants of Liquid Chlorine Trifluoride and Iodine Pentafluoride". Journal of the American Chemical Society 76 (19): 4841–4843. doi:10.1021/ja01648a021.
- Booth, H. S.; Pinkston, J. T. Jr. (1947). "The Halogen Fluorides". Chemical Reviews 41 (3): 421–439. doi:10.1021/cr60130a001.