இலித்தியம் கோபால்ட் ஆக்சைடு
இலித்தியம் கோபால்ட் ஆக்சைடு (Lithium cobalt oxide) என்பது LiCoO2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். இலித்தியம் கோபால்ட்டேட்டு [2] அல்லது இலித்தியம் கோபால்ட்டைட்டு [3] என்ற பெயர்களாலும் இச்சேர்மம் அழைக்கப்படுகிறது. கோபால்ட்டு அணுக்கள் பொதுவாக + 3 என்ற ஆக்சிசனேற்ற நிலையிலிருப்பதால் ஐயுபிஏசி முறையில் இதை இலித்தியம் கோபால்ட்(III) ஆக்சைடு என்கிறார்கள்.
 | |
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
இலித்தியம் கோபால்ட்டு(III) ஆக்சைடு
| |
| வேறு பெயர்கள்
இலித்தியம் கோபால்டைட்டு
| |
| இனங்காட்டிகள் | |
| 12190-79-3 | |
| பப்கெம் | 23670860 |
| பண்புகள் | |
| LiCoO 2 | |
| வாய்ப்பாட்டு எடை | 97.87 கி மோல்−1 |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | தீங்கானது |
| R-சொற்றொடர்கள் | R42/43 |
| S-சொற்றொடர்கள் | S36 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
இலித்தியம் கோபால்ட் ஆக்சைடு அடர் நீல நிறம் அல்லது நீலம் கலந்த பச்சை நிறத்தில் படிகத் திண்மமாகக் காணப்படுகிறது [4]. இலித்தியம் அயனி மின்கலன்களில் பொதுவாக நேர்மின் முனையாகப் பயன்படுத்தப்படுகிறது.
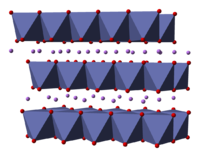
கட்டமைப்பு
தொகுLiCoO2 இன் கட்டமைப்பு எக்சு கதிர் விளிம்பு, எலக்ட்ரான் நுண்ணோக்கி, நியூட்ரான் தூள் விளிம்பு , நீட்டிக்கப்பட்ட எக்சுகதிர் ஈர்ப்பு உள்ளிட்ட பல நுட்பங்களுடன் LiCoO2 இன் கட்டமைப்பு ஆய்வு செய்யப்பட்டுள்ளது [5].
இத் திடப்பொருளானது ஒற்றை இணைதிறன் இலித்தியம் நேர்மின் அடுக்குகால் ஆனதாகும். இது கோபால்ட்டு மற்றும் ஆக்சிசன் அணுக்களின் நீட்டிக்கப்பட்ட எதிர்மின் அயனி தாள்களுக்கு இடையில் உள்ளது, அவை விளிம்பு-பகிர்வு எண்முகத்தில் சமதளத்துக்கு இணையாக இரண்டு முகங்கள் நோக்கும் வகையில் அடுக்கப்பட்டுள்ளன [6]. கோபால்ட் அணுக்கள் முறையாக மூவிணைதிற ஆக்சிசனேற்ற நிலையில் உள்ளன. மற்றும் இவை ஆக்சிசன் அணுக்களின் இரண்டு அடுக்குகளுக்கு இடையில் வைக்கப்பட்டுள்ளன.
கோபால்ட்,டு ஆக்சிசன் அல்லது லித்தியம் அணுக்கள் கொண்ட ஒவ்வொரு அடுக்கிலும் அணுக்கள் வழக்கமான முக்கோண பின்னல்களில் அடுக்கப்பட்டிருக்கும் இலித்தியம் அணுக்கள் கோபால்ட்டு அணுக்களிலிருந்து வெகு தொலைவில் இருக்கும் வகையில் இப்பின்னல்கள் ஈடுசெய்யப்படுகின்றன, மேலும், ஒவ்வொரு மூன்று கோபால்ட்டு அல்லது இலித்தியம் அடுக்குகளுக்கும் சமதளங்களுக்கு செங்குத்தான திசையில் கட்டமைப்பு மீண்டும் நிகழ்கிறது. எனவே எர்மான் மாகுயின் குறியீட்டு முறையில் இடக்குழுவானது R 3எம் என்று குறிக்கப்படுகிறது. இதன் பொருள் ஒரு நாற்கரம் போன்ற அலகு செல் மூன்று மடங்கு ஒழுங்கற்ற சுழற்சி சீர்மை மற்றும் ஒரு சமதள அச்சுடன் உள்ளது என்பது பொருளாகும். அடுக்குகளுக்கு இயல்பான மும்மடிப்பு சுழற்சி அச்சு முறையற்றது என அழைக்கப்படுகிறது, ஏனெனில் ஆக்சிசனின் முக்கோணங்கள் (ஒவ்வொரு எண்முகத்தின் எதிர் பக்கங்களிலும் இருப்பது) சீரமைக்கப்பட்டவையாகும் [7].
தயாரிப்பு
தொகுஇலித்தியம் கார்பனேட் (Li2CO3) மற்றும் கோபால்ட்டு (II,III) ஆக்சைடு இரண்டும் விகிதவியல் அளவுகளில் சேர்க்கப்பட்டு சூடுபடுத்தப்பட்டால் முழுமையாகக் குறைக்கப்பட்ட இலித்தியம் கோபால்ட்டு ஆக்சைடு தயாரிக்கப்படுகிறது. அல்லது உலோக கோபால்ட்டை 600 பாகை முதல் 800 பாகை செல்சியசு வெப்பநிலை வரையிலான உயர்ந்த அளவு வெப்பநிலையில் காய்ச்சிக் குளிரவைத்தாலும் இது உருவாகிறது. இவையனைத்துமே ஆக்சிசன் சூழலில் பலமணி நேரத்திற்கு வைக்கப்பட்டால் ,மட்டுமே இலித்தியம் கோபால்ட்டு ஆக்சைடு உருவாகிறது [3][6][7].
.
எதிர்மின் முனை பயன்பாட்டுக்கு பொருத்தமான மீநுண்ணளவு அளவு துகள்களும் நீரேற்ற கோபால்ட்டு ஆக்சலேட்டை (β-CoC2O4•2H2O) இலித்தியம் ஐதராக்சைடு சேர்த்து 750-900 பாகை செல்சியசு வெப்பநிலையில் சுடுவதன் மூலம் பெறப்படுகிறது. பெறப்படும் விளைபொருள் தண்டு வடிவ படிகங்களாக 8 μm நீளமும் 0.4 μm அகலமும் கொண்ட துகள்களாகும். இலித்தியம் அசிட்டேட்டு, கோபால்ட்டு அசிட்டேட்டு, மற்றும் சிட்ரிக் அமிலம் ஆகிய மூன்றையும் சம மோலார் அளவுகளில் நீர்க்கரைசலில் இட்டு சூடுபடுத்தி தயாரிப்பது மூன்றாவது வழிமுறையாகும். 80 பாகை செல்சியசு வெப்பநிலைக்கு சூடாக்கும் போது வினை கலவை ஒளிபுகும் அரைதிண்மக் கரைசலாக மாறுகிறது. உலர் அரைதிண்மக் கரைசல் பின்னர் மாவாக்கப்பட்டு படிப்படியாக 550 செல்சியசு வெப்பநிலைக்கு சூடாக்கப்படுகிறது.
பயன்கள்
தொகுஇலித்தியம் கோபால்ட்டு ஆக்சைடு ஓர் இடைச்செருகல் மின்முனையாக பயன்படுவதை 1980 ஆம் ஆண்டு யான் பி கூட்டன்பெர்க்கு ஆய்வுக் குழு ஆக்சுபோர்டில் கண்டுபிடித்து வெளியிட்டது [9].
ஒரு நேர்மின் முனையாக இச்சேர்மம் ஒருசில புதுப்பிக்கத்தக்க இலித்தியம்- அயனி மின்கலன்களில் பயன்படுத்தப்படுகிறது. இவற்றில் துகள்களின் அளவு நானோமீட்டர் முதல் மைக்ரோமீட்டர் வரை மாறுபடுகிறது [10][11]. மின்சுமை ஏற்றத்தின் போது கோபால்ட்டு பகுதியாக +4 ஆக்சிசனேற்ற நிலைக்கு ஆக்சிசனேற்றப்படுகிறது. சில இலித்தியம் அணுக்கள் மின் முனையை நோக்கி நகர்கின்றன. இதனால் 0 < x < 1 என்ற மதிப்பு கொண்ட பல்வேறு சேர்மங்கள் உருவாகின்றன [3].
LiCoO2 உடன் தயாரிக்கப்படும் மின்கலன்கள் மிகவும் நிலையான கொள்திறன்களைக் கொண்டுள்ளன, ஆனால் நிக்கல்-கோபால்ட்-அலுமினியம் ஆக்சைடுகளை அடிப்படையாகக் கொண்ட எதிர்மின் முனைகளைக் காட்டிலும் குறைந்த திறன் மற்றும் சக்தியைக் கொண்டுள்ளன. மற்ற நிக்கல் மிகுதி சேர்மங்களைக்காட்டிலும் இலித்தியம் கோபால்ட்டு ஆக்சைடு நேர்மின்வாய்கள் வெப்பநிலைப்புத்தன்மை கொண்டவை என்றாலும் அவை குறிப்பிடதக்க அளவுக்கு அதிகம் இல்லை. அதிகவெப்பநிலை இயக்கம் அல்லது மிகை மின்சுமையேற்றம் போன்ற அசம்பாவிதங்கள் நேரிடும்போது இவை எளிதாக பாதிக்கப்பட்டு வெப்ப விலகலுக்கு ஆளாகின்றன. மிக உயர்ந்த வெப்பநிலையில் LiCoO2 இன் சிதைவு ஆக்சிசனை உற்பத்தி செய்கிறது. இது மின்கலனிலுள்ள கரிம்மின்பகுளியுடன் வினைபுரியத் தொடங்குகிறது. வெப்ப உமிழ்வு வினையின் அளவு காரணமாக இது ஒரு பாதுகாப்புக் கவலையாகும், இது மேலும் அருகிலுள்ள கலங்களுக்கு பரவலாம் அல்லது அருகிலுள்ள எரியக்கூடிய பொருளைப் பற்றவைக்கலாம் [12]. பொதுவாக, இது பல இலித்தியம் அயனி மின்கலன்களில் எதிர்மின்வாய்களில் காணப்படுகிறது.
மேற்கோள்கள்
தொகு- ↑ 442704 - Lithium cobalt(III) oxide (2012-09-14). "Sigma-Aldrich product page". Sigmaaldrich.com. பார்க்கப்பட்ட நாள் 2013-01-21.
{{cite web}}: CS1 maint: numeric names: authors list (link) - ↑ A. L. Emelina, M. A. Bykov, M. L. Kovba, B. M. Senyavin, E. V. Golubina (2011), "Thermochemical properties of lithium cobaltate". Russian Journal of Physical Chemistry, volume 85, issue 3, pages 357–363; எஆசு:10.1134/S0036024411030071
- ↑ 3.0 3.1 3.2 Ondřej Jankovský, Jan Kovařík, Jindřich Leitner, Květoslav Růžička, David Sedmidubský (2016) "Thermodynamic properties of stoichiometric lithium cobaltite LiCoO2". Thermochimica Acta, volume 634, pages 26-30. எஆசு:10.1016/j.tca.2016.04.018
- ↑ LinYi Gelon New Battery Materials Co., Ltd, "Lithium Cobalt Oxide (LiCoO2) for lithium ion battery ". Catalog entry, accessed on 2018-04-10,
- ↑ I. Nakai; K. Takahashi; Y. Shiraishi; T. Nakagome; F. Izumi; Y. Ishii; F. Nishikawa; T. Konishi (1997). "X-ray absorption fine structure and neutron diffraction analyses of de-intercalation behavior in the LiCoO2 and LiNiO2 systems". Journal of Power Sources 68 (2): 536–539. doi:10.1016/S0378-7753(97)02598-6. https://archive.org/details/sim_journal-of-power-sources_1997-10_68_2/page/536.
- ↑ 6.0 6.1 Yang Shao-Horn; Laurence Croguennec; Claude Delmas; E. Chris Nelson; Michael A. O'Keefe (July 2003). "Atomic resolution of lithium ions in LiCoO
2". Nature Materials 2 (7): 464–467. doi:10.1038/nmat922. பப்மெட்:12806387. https://digital.library.unt.edu/ark:/67531/metadc736745/. - ↑ 7.0 7.1 H. J. Orman; P. J. Wiseman (January 1984). "Cobalt(III) lithium oxide, CoLiO
2: structure refinement by powder neutron diffraction". Acta Crystallographica Section C 40 (1): 12–14. doi:10.1107/S0108270184002833. - ↑ Qi, Zhaoxiang; Koenig, Gary M. (2016-08-16). "High-Performance LiCoO2Sub-Micrometer Materials from Scalable Microparticle Template Processing" (in en). ChemistrySelect 1 (13): 3992–3999. doi:10.1002/slct.201600872. பன்னாட்டுத் தர தொடர் எண்:2365-6549.
- ↑ K. Mizushima, P. C. Jones, P. J. Wiseman, J. B. Goodenough (1980), "Li
xCoO
2 (0<x<1): A New Cathode Material for Batteries of High Energy Density". Materials Research Bulletin, volume 15, pages 783–789. எஆசு:10.1016/0025-5408(80)90012-4 - ↑ Tang, W.; Liu, L. L.; Tian, S.; Li, L.; Yue, Y. B.; Wu, Y. P.; Guan, S. Y.; Zhu, K. (2010-11-01). "Nano-LiCoO2 as cathode material of large capacity and high rate capability for aqueous rechargeable lithium batteries". Electrochemistry Communications 12 (11): 1524–1526. doi:10.1016/j.elecom.2010.08.024.
- ↑ Qi, Zhaoxiang (August 2016). "High-Performance LiCoO2 Sub-Micrometer Materials from Scalable Microparticle Template Processing". ChemistrySelect 1 (13): 3992–3999. doi:10.1002/slct.201600872.
- ↑ Doughty, Daniel; Pesaran, Ahmad. "Vehicle Battery Safety Roadmap Guidance" (PDF). National Renewable Energy Laboratory. பார்க்கப்பட்ட நாள் 19 January 2013.