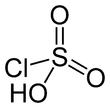
குளோரோகந்தக அமிலம்
குளோரோகந்தக அமிலம் (Chlorosulfuric acid) HSO3Cl. என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படுகிறது. ஐயுபிஏசி முறையில் சல்பியுரோகுளோரிடிக் அமிலம் என்றும் குளோரினின் சல்போனிக் அமிலமாக உள்ளபோது குளோரோசல்போனிக் அமிலம் என்றும் வேறு பெயர்களால் அழைக்கப்படுகிறது. வடிகட்டக்கூடிய, நிறமற்ற நீர்மமான இச்சேர்மம் ஒரு நீருறிஞ்சியாகவும் சக்திவாய்ந்த கண்ணீர் வரவழைக்கும் முகவராகவும் பண்புகளைப் பெற்றுள்ளது. வணிக மாதிரிகள் பொதுவாக வெளிர் பழுப்பு அல்லது வைக்கோல் நிறத்தில் இருக்கின்றன. [2] குளோரோகந்தக அமிலத்தின் உப்புகளும் எசுத்தர்களும் குளோரோ சல்பேட்டுகள் எனப்படுகின்றன.
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
சல்பியூரோகுளோரிடிக் அமிலம்
| |||
| வேறு பெயர்கள்
குளோரோசல்பியூரிக் அமிலம்,
குளோரோசல்போனிக் அமிலம், குளோரின்சல்போனிக் அமிலம், குளோரிடோசல்போனிக் அமிலம், சல்பியூரிக் குளோரோ ஐதரின் | |||
| இனங்காட்டிகள் | |||
| 7790-94-5 | |||
| ChemSpider | 23040 | ||
| EC number | 232-234-6 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 24638 | ||
| வே.ந.வி.ப எண் | FX5730000 | ||
| |||
| UNII | 2O9AXL1TJ4 | ||
| UN number | 1754 | ||
| பண்புகள் | |||
| HSO3Cl | |||
| வாய்ப்பாட்டு எடை | 116.52 கி மோல்−1 | ||
| தோற்றம் | நிறமற்ற நீர்மம், வணிக மாதிரிகள் வெளிர் பழுப்பு | ||
| அடர்த்தி | 1.753 கி செ.மீ−3 | ||
| உருகுநிலை | −80 °C (−112 °F; 193 K) | ||
| கொதிநிலை | 151 முதல் 152 °C (304 முதல் 306 °F; 424 முதல் 425 K) (755 mmHg or 100.7 kPa) | ||
| நீராற்பகுப்பு | |||
| பிற கரைப்பான்கள்-இல் கரைதிறன் | ஆல்ககால்களுடன் வினைபுரியும் குளோரோகார்பன்களில் கரையும் | ||
| ஒளிவிலகல் சுட்டெண் (nD) | 1.433 | ||
| கட்டமைப்பு | |||
| மூலக்கூறு வடிவம் | |||
| தீங்குகள் | |||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 1039 | ||
| GHS pictograms |  
| ||
| GHS signal word | அபாயம் | ||
| H314, H335 | |||
| P260, P261, P264, P271, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P312, P321, P363, P403+233 | |||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
அமைப்பு
தொகுகுளோரோகந்தக அமிலத்தின் மூலக்கூறு நான்முகி வடிவில் உள்ளது. SO2(OH)Cl என்று விரிவாக்கியும் மூலக்கூற்று வாய்ப்பாடு எழுதப்படுகிறது. பாரம்பரியமாக HSO3Cl என்ற முறையில் மூலக்கூற்று வாய்ப்பாடு எழுதப்பட்டு வருகிறது.
பொதுவாக வேதியியல் ரீதியாகவும் கருத்தியல் ரீதியாகவும் இச்சேர்மம் சல்பியூரைல் குளோரைடு (SO2Cl2) மற்றும் கந்தக அமிலம் (H2SO4) ஆகியவற்றுக்கு இடையே உள்ள ஓர் இடைநிலை ஆகும். [3] அரிதாகவே தூய்மையானதாக தயாரிக்கப்படுகிறது. அதிகப்படியான கந்தக மூவாக்சைடுடன் நிற்கும்போது, இது பைரோசல்பியூரைல் குளோரைடுகளாகச் சிதைகிறது: :[4]
- 2 ClSO3H + SO3 → H2SO4 + S2O5Cl2
தயாரிப்பு
தொகுஐதரசன் குளோரைடுடன் கந்தக அமிலத்திலுள்ள கந்தக மூவாக்சைடைச் சேர்த்து தொழிற்சாலைகளில் குளோரோகந்தக அமிலம் தயாரிக்கப்படுகிறது.:[4]
- HCl + SO3 → ClSO3H
கந்தக அமிலத்தை குளோரினேற்றம் செய்தும் இதை தயாரிக்கலாம். இங்கு மூலக்கூற்று வாய்ப்பாட்டை H2SO4 என்று எழுவதற்குப் பதிலாக கற்பித்தல் காரணங்களுக்காக HSO3(OH) என்று மாற்றி எழுதுவார்கள். PCl5 + HSO3(OH) → HSO3Cl + POCl3 + HCl இரண்டாவதாகக் கூறப்பட்ட முறையே பொதுவாக ஆய்வக அளவு தயாரிப்புகளுக்குப் பயன்படுத்தப்படுகிறது. HSO3(OH)
பயன்பாடுகள்
தொகுஅழுக்கு நீக்கிகளாகவும் வேதியியல் இடைநிலைகளாகவும் பயன்படும் கரிம சல்பேட்டுகளைத் தயாரிப்பதற்கு ClSO2OH பயன்படுகிறது.
- ROH + ClSO3H → ROSO3H + HCl
ஆர்த்தோ- மற்றும் பாரா-தொலுவீன்சல்போனைல் குளோரைடு வழிப்பெறுதிகளைப் பெறுவதற்காக ClSO2OH உடன் தொலுவீன் ஈடுபடும் வினை சாக்கரின் தயாரிப்புக்கான ஆரம்ப வினையாக உள்ளது.
- CH3C6H5 + 2 ClSO2OH → CH3C6H4SO2Cl + H2SO4 + HCl
ஆர்த்தோ மாற்றியனின் ஆக்சிசனேற்றம் பென்சோயிக் அமிலத்தின் வழிப்பெறுதிகளை அளிக்கிறது. பின்னர் இது அம்மோனியாவுடன் சேர்த்து வளையமாக்கல் வினைக்கு உட்படுத்தப்பட்டு பின்னர் ஒரு காரத்தால் நடுநிலையாக்கம் செய்யப்பட்டு சாக்கரின் தயாரிக்கப்படுகிறது.
ஆளில்லா விமானங்களில் இறக்கையின் மேற்பரப்பிற்கு மேலே உள்ள காற்றழுத்தம் குறைவதால் ஒடுக்கம் அல்லது இயந்திரம் வெளியேற்றும் நீராவியால் உருவாகும் செயற்கை மேகத்தை எதிர்க்கும் முகவராக குளோரோகந்தக அமிலம் பயன்படுத்தப்படுகிறது.[5] இத்தகைய விமான்ங்களின் இயக்கம் மற்றும் இருப்பிடத்தை மறைக்க உதவும் புகைத் திரையை உருவாக்கவும் இச்சேர்மம் பயன்படுத்தப்படுகிறது. [6][7]
பாதுகாப்பு
தொகுதண்ணீருடன் ClSO3H தீவிரமாக வினையில் ஈடுபட்டு கந்தக அமிலத்தையும் ஐதரசன் குளோரைடு வாயுவையும் வெளியிடுகிறது. பொதுவாக வாயு வெளிப்படும் வினை என்பதால் எச்சரிக்கையுடன் செயல்பட வேண்டும்.
- ClSO3H + H2O → H2SO4 + HCl
HCl உடன் தொடர்புடைய சரியான காற்றோட்டம் போன்ற முன்னெச்சரிக்கைகள் இவ்வினையின் போது கவனிக்கப்பட வேண்டும்.
தொடர்புடைய சில ஆலோகந்தக அமிலங்கள்
தொகு- புளோரோசல்போனிக் அமிலம், FSO2OH, வலிமையான அமிலம். குறைவான ஐதரசன் புளோரைடு வாயுவை வெளியிடும்.
- புரோமோசல்போனிக் அமிலம், BrSO2OH, இது நிலைப்புத்தன்மை அற்றதாகும். இதன் உருகுநிலையான 8 பாகை செல்சியசு வெப்பநிலையின் போது புரோமின், கந்தக டை ஆக்சைடு, கந்தக அமிலம் என்றவாறு சிதைவடைகிறது.
- அயோடோசல்போனிக் அமிலத்தின் உருவாக்கம் அறியப்படவில்லை.
மேற்கோள்கள்
தொகு- ↑ "New Environment Inc. - NFPA Chemicals".
- ↑ Cremlyn, R. J. (2002). Chlorosulfonic Acid. Royal Society of Chemistry. பன்னாட்டுத் தரப்புத்தக எண் 978-0-85404-498-6.
- ↑ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. pp. 549–550.
- ↑ 4.0 4.1 "Chlorosulfuric Acid". Ullmann's Encyclopedia of Industrial Chemistry. (2002). Weinheim: Wiley-VCH. DOI:10.1002/14356007.a07_017. பன்னாட்டுத் தரப்புத்தக எண் 3527306730.
- ↑ Method and apparatus for suppressing contrails (PDF). United States Patent and Trademark Office. 1970.
- ↑ The Royal Navy at War[DVD].London:Imperial War Museum.
- ↑ Amos, Jonathan (2018-04-11). "Nazi legacy found in Norwegian trees". BBC News Online. பார்க்கப்பட்ட நாள் 2018-04-17.