சீசியம் சல்பைடு
வேதிச் சேர்மம்
சீசியம் சல்பைடு (Caesium sulfide) என்பது Cs2S என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். நீரிய கரைசலில் இது ஓர் வலிமையான காரமாகச் செயல்படுகிறது. சீசியம் சல்பைடு காற்றில் அழுகிய முட்டையின் நாற்றத்தை உமிழ்கிறது.
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
சீசியம் சல்பைடு
| |
| இனங்காட்டிகள் | |
| 12214-16-3 | |
| ChemSpider | 22499401 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 14496896 |
| |
| பண்புகள் | |
| Cs2S | |
| வாய்ப்பாட்டு எடை | 297.876 |
| தோற்றம் | வெண்மை நிற படிகங்கள் |
| அடர்த்தி | 4.19 கிராம்.செ.மீ−3 |
| உருகுநிலை | 480 °செல்சியசு[1] |
| நீராற்பகுப்பில் சீசியம் பைசல்பைடு தோன்றும்[2] | |
| எத்தனால் மற்றும் கிளிசரால்-இல் கரைதிறன் | கரையும் |
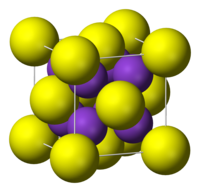
| கட்டமைப்பு | |
| படிக அமைப்பு | கனசதுரம், எதிர்-புளோரைட்டு |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | நஞ்சு |
| GHS pictograms |  
|
| GHS signal word | அபாயம் |
| H314, H400 | |
| P260, P264, P273, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P391, P405, P501 | |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | சீசியம் ஆக்சைடு சீசியம் செலீனைடு சீசியம் தெலூரைடு சீசியம் பொலோனைடு |
| ஏனைய நேர் மின்அயனிகள் | இலித்தியம் சல்பைடு சோடியம் சல்பைடு பொட்டாசியம் சல்பைடு உருபீடியம் சல்பைடு பிரான்சியம் சல்பைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகுசீசியம் மற்றும் கந்தகத்தை டெட்ரா ஐதரோ பியூரானில் வினைபுரியச் செய்து சோடியம் சல்பைடைப் போலவே நீரிலி சீசியம் சல்பைடையும் தயாரிக்கலாம். வினை நிகழ அமோனியா அல்லது நாப்தலீன் வினைக்கலவையுடன் சேர்க்கப்படவேண்டும்.[3]
- 2Cs + S → Cs2S
ஐதரசன் சல்பைடை சீசியம் ஐதராக்சைடு கரைசலில் கரைத்து சீசியம் பைசல்பைடை தயாரிக்க முடியும். பின்னர் இதிலிருந்தும் சீசியம் சல்பைடு கிடைக்கிறது.[4][5]。
- CsOH + H2S → CsHS + H2O
- CsHS + CsOH → Cs2S + H2O
மேற்கோள்கள்
தொகு- ↑ Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, பன்னாட்டுத் தரப்புத்தக எண் 978-0-8493-8671-8, S. 336 ([1], p. 336, கூகுள் புத்தகங்களில்).
- ↑ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, பன்னாட்டுத் தரப்புத்தக எண் 978-3-5406-0035-0, S. 692 ([2], p. 692, கூகுள் புத்தகங்களில்).
- ↑ J.-H. So and P. Boudjouk (1992). N. G. Russell. ed. "Hexamethyldisilathiane". Inorganic Syntheses: 30–32. doi:10.1002/9780470132609.ch11. பன்னாட்டுத் தரப்புத்தக எண்:9780470132609.
- ↑ Wilhelm Blitz, Ernst Wilke-Dörfurt: "Über Sulfide des Rubidiums und Cäsiums" in Zeitschr. f. anorg. Chem. 1906. 48, S. 297–317. Volltext
- ↑ R. Abegg, F. Auerbach: 'Handbuch der anorganischen Chemie'. Verlag S. Hirzel, Bd. 2, 1908. S. 430.Volltext