துத்தநாக சயனைடு
துத்தநாக சயனைடு (Zinc cyanide) Zn(CN)2 என்ற மூலக்கூற்று வாய்பாட்டை உடைய கனிமச் சேர்மம் ஆகும். இது வெண்ணிறத் திண்மமாகவும், முக்கியமாக துத்தநாக முலாம் பூசுதலிலும் பயன்படுகிறது. இவை தவிர கரிமச்சேர்மங்களைத் தொகுப்பு முறையில் தயாரிப்பதில் பல சிறப்பு வாய்ந்த பயன்பாடுகளையும் கொண்டுள்ளது.
| |
| இனங்காட்டிகள் | |
|---|---|
| 557-21-1 | |
| ChemSpider | 10713 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 11186 |
| வே.ந.வி.ப எண் | ZH1575000 |
| |
| பண்புகள் | |
| Zn(CN)2 | |
| வாய்ப்பாட்டு எடை | 117.444 கி/மோல் |
| தோற்றம் | வெண்ணிறத் துாள் |
| அடர்த்தி | 1.852 கி/செமீ3, solid |
| உருகுநிலை | 800 °C (1,470 °F; 1,070 K) (சிதைவுறுகிறது) |
| 0.00005 கி/100 மிலி (20 °செ) | |
| கரைதிறன் | காரங்களால் பாதிக்கப்படுகிறது, KCN, அம்மோனியா |
| −46.0·10−6 cm3/mol | |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | பட்டியலிடப்படவில்லை |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
100 மிகி/கிகி, rat (intraperitoneal) |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
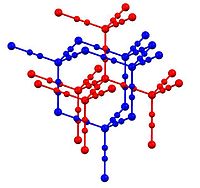
அமைப்பு
தொகுதுத்தநாக சயனைடில் (Zn(CN)2) துத்தநாகமானது நான்முகி ஈந்திணைப்புச் சூழலை ஏற்கிறது. துத்தநாகத்தின் அனைத்து ஈந்திணைப் பிணைப்புகளும் இணைக்கக்கூடிய சயனைடு ஈனிகளால் இணைக்கப்பட்டுள்ளது. இந்த வடிவமானது இரண்டு ஒன்றோடு ஒன்று ஊடுருவிய அமைப்புகளைக் கொண்டுள்ளது. (நீலம் மற்றும் சிவப்பு நிறங்களில் படத்தில் காட்டப்பட்டுள்ளது) இத்தகைய அலங்காரமான அமைப்பு சில நேரங்களில் விரிவாக்கப்பட்ட வைர வடிவமைப்பு என அழைக்கப்படுகிறது. சிலிக்காவின் சில வடிவங்களில் நான்முகி வடிவின் மைய அணுவாக உள்ள சிலிக்கன் அணு ஆக்சைடுகளால் இணைக்கப்பட்டுள்ள இதையொத்த வடிவைக் கொண்டுள்ளன. சயனைடு தொகுதியானது ஒன்று முதல் அடுத்தடுத்த நான்கு கார்பன் அணுக்கள் அடுத்த உறுப்புகளாக இருக்கும் நிலையிலும் மீதமுள்ளவை நைட்ரசன் அணுக்களாகவும் உள்ள நிலையில் தலையிலிருந்து வாலுக்குச் செல்லும் ஒழுங்கின்மையை வெளிப்படுத்துகிறது.[2] இந்தச் சேர்மமானது மிகப்பெரிய வெப்பத்தால் விரிவடைதல் குணகத்தைக் கொண்டுள்ளது. முன்னதாக துத்தநாக டங்ஸ்டேட் வசமிருந்த இந்த சாதனையை துத்தநாக சயனைடு விஞ்சியது.
வேதியியல் பண்புகள்
தொகுகனிம பலபடிகளில் தனித்தன்மை வாய்ந்த , Zn(CN)2பெரும்பான்மையான கரைப்பான்களில் கரைவதில்லை. திண்மமாகது ஐதராக்சைடு, அம்மோனியா போன்ற அடிப்படையான ஈனிகளைக் கொண்ட கரைசல்களில் மிக எளிதாகவும், முழுவதுமாகவும் கரைந்து கூடுதல் எதிர் மின் அயனி கூட்டுப்பொருட்களைத் தருகின்றது.
தொகுப்பு முறை தயாரிப்பு
தொகுZn(CN)2 வைத் தயாரிப்பதற்கு சயனைடு மற்றும் துத்தநாக அயனிகளைக் கொண்டுள்ள நீரிய கரைசல்களை ஒன்றாக சேர்ப்பதால் (உதாரணமாக KCN மற்றும் ZnSO4 ஆகிய உப்புக்களுக்கிடையே நடைபெறும் இரட்டை இடப்பெயர்ச்சி வினைகளின் விளைவாக) எளிமையாக தயாரிக்கலாம்.[3]
- ZnSO4 + 2 KCN → Zn(CN)2 + K2SO4
வணிகவியல் பயன்பாடுகளுக்காக ஆலைடு மாசுகளைத் தவிர்க்க துத்தநாகத்தின் அசிட்டேட் உப்புக்களைப் பயன்படுத்துவதன் மூலம் சில முயற்சிகள் மேற்கொள்ளப்படுகிறது.
தங்கத்தைப் பிரித்தெடுக்கும் முறைகளில் துத்தநாக சயனைடானது துணை விளைபொருளாகவும் தயாரிக்கப்படுகிறது. தங்கத்தை நீரிய தங்க சயனைடுகளிலிருந்து பிரித்தெடுக்கும் முறைகளில், சில நேரங்களில் துத்தநாகம் சேர்க்கப்பட வேண்டிய அவசியம் எழுகிறது.
- 2 [Au(CN)2]− + Zn → 2 Au + Zn(CN)2 + 2 CN−
பயன்பாடுகள்
தொகுமின்முலாம் பூசுதல்
தொகுதுத்தநாக சயனைடின்Zn(CN)2 மிக முக்கியப் பயனாக துத்தநாகத்தை கூடுதல் சயனைடைக் கொண்டுள்ள நீரிய கரைசல்களிலிருந்து முலாம் பூசுதல் இருக்கிறது.[4]
கரிம தொகுப்பு முறை
தொகுதுத்தநாக சயனைடானது Zn(CN)2 அரோமேடிக் சேர்மங்களில் பார்மைல் தொகுதியை அறிமுகப்படுத்த உதவும் காட்டர்மேன் வினையில் பயன்படுகிறது. இந்த வினையில் துத்தநாக சயனைடானது ஐதரசன் சயனைடுக்குப் (HCN)[5] பதிலான, வசதியான மற்றும் பாதுகாப்பான மாற்றாகப் பயன்படுகிறது. ஏனென்றால், ஐதரோகுளோரிக் அமிலம் (HCl) மற்றும் துத்தநாக சயனைடுகளைக் (Zn(CN)2) கொண்ட வினையானது துத்தநாக குளோரைடு(ZnCl2)போன்ற லுாயிசு அமில வினைவேகமாற்றியைத் தருகிறது. 2-ஐதராக்சி-1-நாப்தால்டிகைடு மற்றும் மெசிட்டால்டிகைடு ஆகியவற்றின் தொகுப்பு முறைகளில் துத்தநாக சயனைடு இதே விதத்தில் பயன்படுகிறது.[6]
துத்தநாக சயனைடு, Zn(CN)2, ஆல்டிகைடுகள் மற்றும் கீட்டோன்களின் சயனோஅசிலைலேற்ற வினைகளில் வினைவேகமாற்றியாகவும் பயன்படுகிறது.[7]
மேற்கோள்கள்
தொகு- ↑ http://cameochemicals.noaa.gov/chemical/4808
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry Vol. 2, 2nd Ed. Newyork: Academic Press. p. 1087. பன்னாட்டுத் தரப்புத்தக எண் 9780323161299.
{{cite book}}: More than one of|ISBN=and|isbn=specified (help) - ↑ Ernst Gail, Stephen Gos, Rupprecht Kulzer, Jürgen Lorösch, Andreas Rubo and Manfred Sauer "Cyano Compounds, Inorganic" Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2004. எஆசு:10.1002/14356007.a08_159.pub2
- ↑ Adams, Roger (1957). Organic Reactions, Volume 9. New York: John Wiley & Sons, Inc. pp. 53–54. பன்னாட்டுத் தரப்புத்தக எண் 9780471007265. பார்க்கப்பட்ட நாள் 18 July 2014.
{{cite book}}: More than one of|ISBN=and|isbn=specified (help); More than one of|accessdate=and|access-date=specified (help); More than one of|first1=and|first=specified (help); More than one of|last1=and|last=specified (help) - ↑ Adams R., Levine I. (1923). "Simplification of the Gattermann Synthesis of Hydroxy Aldehydes". J. Am. Chem. Soc. 45 (10): 2373–77. doi:10.1021/ja01663a020.
- ↑ Rasmussen J. K., Heilmann S. M. (1990). "In situ Cyanosilylation of Carbonyl Compounds: O-Trimethylsilyl-4-Methoxymandelonitrile". Organic Syntheses. doi:10.15227/orgsyn.062.0196.; Collective Volume, vol. 7, p. 521