பொட்டாசியம் ஆக்சைடு
பொட்டாசியம் ஆக்சைடு (Potassium oxide ), என்பது K2O. என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட வேதிச் சேர்மம் ஆகும். பொட்டாசியம் மற்றும் ஆக்சிசன் இணைந்து உருவாகும் பொட்டாசியத்தின் எளிய ஆக்சைடான இது வெளிரிய மஞ்சள் நிறத் திண்மமாகக் காணப்படுகிறது. அரிதாக கிடைக்கக்கூடிய இந்த அயனச் சேர்மம் அதிக வினைத்திறனுடன் காணப்படுகிறது. உரங்கள் மற்றும் சிமெண்ட் போன்ற சில வர்த்தகப் பொருட்களின் இயைபு சதவீதம் K2O சேர்மத்திற்கு சமமாக இருக்க வேண்டுமென்று அனுமானித்து மதிப்பிடுகிறார்கள்.
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
பொட்டாசியம் ஆக்சைடு
| |
| முறையான ஐயூபிஏசி பெயர்
பொட்டாசியம் ஆக்சிடோ பொட்டாசியம் | |
| வேறு பெயர்கள்
இருபொட்டாசியம் ஓராக்சைடு, பொட்டாசு
| |
| இனங்காட்டிகள் | |
| 12136-45-7 | |
| ChemSpider | 23354117? |
| EC number | 235-227-6 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| ம.பா.த | Potassium+oxide |
| |
| UNII | 58D606078H |
| பண்புகள் | |
| K2O | |
| வாய்ப்பாட்டு எடை | 94.20 g·mol−1 |
| தோற்றம் | வெளிர் மஞ்சள் திண்மம் |
| மணம் | நெடியற்றது. |
| அடர்த்தி | 2.32 கி/செ.மீ3 (20 °செ)[1] 2.13 கி/செ.மீ3 (24 °செ)[2] |
| உருகுநிலை | 740 °C (1,360 °F; 1,010 K) [2] decomposes from 300 °C[1] |
| வினைபுரியும் [1] KOH உருவாக்கும் | |
| கரைதிறன் | EtOH, ஈதரில் கரையும்[2] |
| கட்டமைப்பு | |
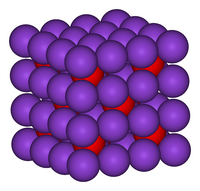
| படிக அமைப்பு | புளோரைட்டுக்கு எதிரானது கனசதுரம், cF12[3] |
| புறவெளித் தொகுதி | Fm3m, No. 225[3] |
| ஒருங்கிணைவு வடிவியல் |
நான்முகம் (K+) கனசதுரம் (O2−) |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−363.17 கியூ/மோல்[1][4] |
| நியம மோலார் எந்திரோப்பி S |
94.03 யூ/மோல்·K[4] |
| வெப்பக் கொண்மை, C | 83.62 யூ/மோல்·K[4] |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | அரிக்கும். நீருடன் தீவிரமாக வினைபுரியும். |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0769 |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | பொட்டாசியம் சல்பைடு |
| ஏனைய நேர் மின்அயனிகள் | இலித்தியம் ஆக்சைடு சோடியம் ஆக்சைடு ருபீடியம் ஆக்சைடு சீசியம் ஆக்சைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
உற்பத்தி
தொகுபொட்டாசியம் மற்றும் ஆக்சிசன் இணையும் வினையில் பொட்டாசியம் ஆக்சைடு உருவாகிறது. தவிர பொட்டாசியத்துடன் அதன் பெராக்சைடைச் சேர்த்து வினைப்படுத்தினாலும் இதைத் தயாரிக்கலாம்.:[5]
- K2O2 + 2 K → 2 K2O
பொட்டாசியம் நைட்ரேட்டுடன் தனிமப் பொட்டாசியத்தைச் சேர்த்து பொட்டாசியம் ஆக்சைடு தயாரிப்பது வசதியானதும் மற்றுமொரு மாற்று முறையாகவும் கருதப்படுகிறது,
- 2 KNO3 + 10 K → 6 K2O + N2
பொட்டாசியம் ஐதராக்சைடை மேலும் நீர்நீக்கம் செய்து ஆக்சைடை பெற முடியாது. ஆனால், இது உருக்கிய உலோகத்துடன் வினைபுரிந்து ஐதரசனை வெளியேற்றி பொட்டாசியம் ஆக்சைடைக் கொடுக்கிறது.
பண்புகள் மற்றும் வினைகள்
தொகுபுளோரைட்டுக்கு எதிரான கட்டமைப்பில் பொட்டாசியம் ஆக்சைடு படிகமாகிறது. இந்நோக்குருவில் எதிர்மின் மற்றும் நேர்மின் அயனிகளின் அமைப்பு கால்சியம் புளோரைடில் அமைந்திருக்கும் அமைவிடத்திற்கு நேரெதிராக உள்ளன. படிகத்தில், பொட்டாசியம் அயனிகள் நான்கு ஆக்சைடு அயனிகளுடன் ஒருங்கிணைவும், ஆக்சைடு அயனிகள் எட்டு பொட்டாசியம் அயனிகளுடன் ஒருங்கிணைவும் கொண்டுள்ளன[6][7] . பொட்டாசியம் ஆக்சைடு ஒரு கார ஆக்சைடு என்பதால் நீருடன் தீவிரமாக வினைபுரிந்து கடுங்கார பொட்டாசியம் ஐதராக்சைடைத் தருகிறது. நீர் ஈர்க்கும் தன்மையுடன் விளங்குவதால் இச்சேர்மம் வளிமண்டலத்தில் உள்ள நீரை உறிஞ்சி தீவிரமான வினைகளைத் தொடங்கி வைக்கிறது.
தொழிற்சாலைகளில் K2O
தொகுபொட்டாசியம் ஆக்சைடின் மூலக்கூற்று வாய்ப்பாடான K2O பல்வேறு தொழிற்சாலை பயன்பாட்டு மொழியில் எளிமையாக K என்ற பயன்பாட்டிடுடன் காணப்படுகிறது. உரத்தொழிலில் N-P-K உரங்கள் என்றும், சிமெண்ட் மற்றும் கண்ணாடி உருவாக்கும் வாய்ப்பாடுகளிலும் இவ்வாறே பயன்படுத்தப்படுகிறது. பொட்டாசியம் ஆக்சைடின் சரியான மூலக்கூற்று வாய்ப்பாடு K2O என்றாலும் மேற்கண்ட பொருட்கள் தயாரிப்பில் இது நேரடியாகப் பயன்படுவதில்லை. பொதுவாக பொட்டாசியம் கார்பனேட்டாகவோ அல்லது வேறு பொட்டாசியம் சேர்மங்களாகவோதான் பயன்படுகிறது. உதாரணமாக, பொட்டாசியம் ஆக்சைடின் எடையில் 83 சதவீதம் பொட்டாசியம் இடம்பெற்றுள்ளது. ஆனால், பொட்டாசியம் குளோரைடில் 52 சதவீதம் பொட்டாசியம் மட்டுமே உள்ளது, பொட்டாசியம் குளோரைடால், பொட்டாசியம் ஆக்சைடு வழங்கும் பொட்டாசியத்தின் அளாவைவிடக் குறைவாகவே வழங்க முடிகிறது. இதன்படி ஒரு உரத்தின் எடையில் 30% பொட்டாசியம் குளோரைடு இருப்பதாகக் கொண்டால் பொட்டாசியம் ஆக்சைடு அடிப்படையில் அதன் பொட்டாசியத்தின் அளவு 18.8% மட்டுமே என்பது இதன் பொருளாகும்.
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 1.2 1.3 Anatolievich, Kiper Ruslan. "potassium oxide". http://chemister.ru. பார்க்கப்பட்ட நாள் 2014-07-04.
{{cite web}}: External link in|website= - ↑ 2.0 2.1 2.2 Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press]isbn = 978-1-4200-9084-0.
- ↑ 3.0 3.1 Wyckoff, Ralph W.G. (1935). The Structure of Crystals (2nd ed.). Reinhold Publishing Corp. p. 25.
{{cite book}}:|work=ignored (help) - ↑ 4.0 4.1 4.2 Dipotassium oxide in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov (retrieved 2014-07-04)
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
- ↑ Eduard Zintl; Harder, A.; Dauth B. (1934). "Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums". Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie 40: 588–93.
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. பன்னாட்டுத் தரப்புத்தக எண் 0-19-855370-6.