பொட்டாசியம் பைசல்பேட்டு
பொட்டாசியம் பைசல்பேட்டு (Potassium bisulphate) என்பது KHSO4 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். கந்தக அமிலத்தினுடைய பொட்டாசியம் அமில உப்பாக இது கருதப்படுகிறது.
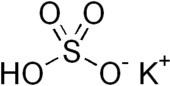
| |

| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
பொட்டாசியம் ஐதரசன் சல்பேட்டு
| |
| வேறு பெயர்கள்
பொட்டாசியம் அமில சல்பேட்டு
| |
| இனங்காட்டிகள் | |
| 7646-93-7 | |
| ChemSpider | 56396 |
| EC number | 231-594-1 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 516920 |
| வே.ந.வி.ப எண் | TS7200000 |
| |
| UN number | 2509 |
| பண்புகள் | |
| KHSO4 | |
| வாய்ப்பாட்டு எடை | 136.169 கி/மோல் |
| தோற்றம் | நிறமற்ற திண்மம் |
| மணம் | நெடியற்றது |
| அடர்த்தி | 2.245 கி/செ.மி3 |
| உருகுநிலை | 197 °C (387 °F; 470 K) |
| கொதிநிலை | 300 °C (572 °F; 573 K) (சிதைவடையும்) |
| 36.6 கி/100 மி.லி (0 °செ) 49 கி/100 மி.லி (20 °செ) 121.6 கி/100 மி.லி (100 °செ) | |
| கரைதிறன் | அசிட்டோன், எத்தனால் போன்றவற்றில் கரையும். |
| −49.8•10−6 செ.மீ3/மோல் | |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-1163.3 கி.யூ/மோல் |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | External MSDS |
| ஈயூ வகைப்பாடு | அரிக்கும் (C) |
| R-சொற்றொடர்கள் | R34, R36, R37, R38 |
| S-சொற்றொடர்கள் | (S1/2), S26, S36/37/39, S45 |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
2340 மி.கி*கி.கி−1 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
இயற்கைத் தோற்றம்
தொகுமெர்காலைட்டு என்ற கனிம வடிவ பொட்டாசியம் பைசல்பேட்டு மிக அரிதாகத் தோன்றுகிறது. மிசெனைட்டு என்ற சிக்கலான கனிம வடிவத்திலும் பொட்டாசியம் பைசல்பேட்டு காணப்படுவதுண்டு.
தயாரிப்பு
தொகுகந்தக அமிலத்தை சம அளவு மோலார் அடர்த்தியுள்ள பொட்டாசியம் ஐதராக்சைடுடன் சேர்த்து நடுநிலையாக்கல் வினைக்கு உட்படுத்தினால் பொட்டாசியம் பைசல்பேட்டு உருவாகிறது [1]
- H2SO4 + KOH → KHSO4 + H2O
கந்தக அமிலத்துடன் பொட்டாசியம் சல்பேட்டுடன் சேர்த்து வினைபுரியச் செய்வதாலும் பொட்டாசியம் பைசல்பேட்டு உருவாகிறது:[2]
- H2SO4 + K2SO4 → 2 KHSO4
பொட்டாசியம் நைட்ரேட்டிலிருந்து நைட்ரிக் அமிலம் தயாரிக்கும் வினையில் முக்கியமான உடன் விளைபொருளாகவும் பொட்டாசியம் பைசல்பேட்டு உருவாகிறது:[3]
- KNO3 + H2SO4 → KHSO4 + HNO3
வேதிப்பண்புகள்
தொகுபொட்டாசியம் பைசல்பேட்டு வெப்பச்சிதைவு அடைவதால் பொட்டாசியம் பைரோசல்பேட்டும் தண்ணீரும் உருவாகின்றன[2]
- 2 KHSO4 → K2S2O7 + H2O
Temperatures above 600 °செல்சியசு வெப்பநிலைக்கு மேல் பொட்டாசியம் பைசல்பேட்டு சிதைவடைந்து பொட்டாசியம் சல்பேட்டையும் கந்தக மூவாக்சைடையும் உருவாக்குகிறது. :[4]
- 2 KHSO4 → K2SO4 + SO3 + H2O
பயன்கள்
தொகுபொட்டாசியம் பைசல்பேட்டு பகுப்பாய்வு வேதியியலில் ஒரு சிதைக்கும் முகவராகப் பயன்படுத்தப்படுகிறது அல்லது பொட்டாசியம் பெர்சல்பெட்டு என்ற வலிமையான ஆக்சிசனேற்றி தயாரிப்பில் ஒரு முன்னோடிச் சேர்மமாகப் பயன்படுகிறது[5] .
மேற்கோள்கள்
தொகு- ↑ McPherson, William (1913). A Course in General Chemistry. New York: Ginn and Company. p. 156. பார்க்கப்பட்ட நாள் 31 December 2015.
- ↑ 2.0 2.1 Washington Wiley, Harvey (1895). Principles and Practice of Agricultural Analysis: Fertilizers. Easton, PA.: Chemical Publishing Co. p. 218. பார்க்கப்பட்ட நாள் 31 December 2015.
- ↑ Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. New York: McGraw-Hill. p. 636. பன்னாட்டுத் தரப்புத்தக எண் 0070494398.
- ↑ Iredelle Dillard Hinds, John (1908). Inorganic Chemistry: With the Elements of Physical and Theoretical Chemistry. New York: John Wiley & Sons. p. 547. பார்க்கப்பட்ட நாள் 31 December 2015.
- ↑ Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry Vol. 1, 2nd Ed. Newyork: Academic Press. p. 392. பன்னாட்டுத் தரப்புத்தக எண் 978-0121266011.