குளோரோபிளாட்டினிக் அமிலம்
குளோரோபிளாட்டினிக் அமிலம் (Chloroplatinic acid) என்பது [H3O]2[PtCl6](H2O)x. என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். இச்சேர்மம் அறுகுளோரோ பிளாட்டினிக் அமிலம் என்றும் அழைக்கப்படுகிறது. சிவப்பு நிறத்துடன் திண்மமாகக் காணப்படும் இச்சேர்மம், வர்த்தக முறையில் தயாரிக்கப்படும் பிளாட்டினத்திற்கு முக்கியமான ஆதாரமாக இருக்கிறது. இச்சேர்மத்தின் வாய்ப்பாட்டைச் சுருக்கமாக H2PtCl6 என்று எழுதுவார்கள். இச்சேர்மம், அறுகுளோரோ பிளாட்டினேட்டு எதிரயனியின் (PtCl62-)(PtCl62-).[1][2] ஐதரோனியம் (H3O+) உப்பாகும். ஒரு அறுநீரேற்றாகவும் குளோரோபிளாட்டினிக் அமிலம் கிடைக்கிறது.

| |
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
டை ஐதரசன் எக்சாகுளோரோபிளாட்டினேட்டு(2–)
| |
| வேறு பெயர்கள்
அறுகுளோரோபிளாட்டினிக் அமிலம்
| |
| இனங்காட்டிகள் | |
| 16941-12-1 | |
| ChemSpider | 55731 |
| EC number | 241-010-7 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 61859 |
| வே.ந.வி.ப எண் | TP1510000 |
| |
| UNII | Q65224GJ7F |
| பண்புகள் | |
| H2PtCl6 | |
| வாய்ப்பாட்டு எடை | 409.81 கி/மோல் |
| தோற்றம் | செம்பழுப்பு திண்மம் |
| அடர்த்தி | 2.431 கி/செ.மீ3 |
| உருகுநிலை | 60 °C (140 °F; 333 K) |
| கொதிநிலை | சிதைவடைகிறது |
| நன்றாகக் கரைகிறது | |
| கட்டமைப்பு | |
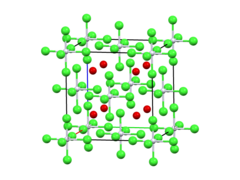
| படிக அமைப்பு | எதிர் புளோரைட்டு. |
| ஒருங்கிணைவு வடிவியல் |
எண்முகம் |
| இருமுனைத் திருப்புமை (Dipole moment) | 0 D |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | External MSDS |
| ஈயூ வகைப்பாடு | Toxic (T) Corrosive (C) |
| R-சொற்றொடர்கள் | R25, R34, R42/43 |
| S-சொற்றொடர்கள் | (S1/2), S22, S26, S36/37/39, S45 |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | அறுகுளோரோபலேடிக் அமிலம் |
| ஏனைய நேர் மின்அயனிகள் | பொட்டாசியம் அறுகுளோரோபிளாட்டினேட்டு, அமோனியம் அறுகுளோரோபிளாட்டினேட்டு, ருபீடியம் அறுகுளோரோபிளாட்டினேட்டு, சீசியம் அறுகுளொரோபிளாட்டினேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகுபிளாட்டினம் புரைம உலோகத்தை இராச திராவகத்தில் கரைத்தால் குளோரோபிளாட்டினிக் அமிலம் உருவாகிறது. இக்கரைசலை ஆவியாக்கினால் பழுப்புச் சிவப்பில் படிகங்கள் உருவாகின்றன.[3]
- Pt + 4 HNO3 + 6 HCl → "H2PtCl6" + 4 NO2 + 4 H2O
இதேபோன்ற தொடர்புடைய மற்றொரு வினையில் அறுநீரேற்று வடிவம் உண்டாகிறது. H2PtCl6(H2O)6.[5] இச்சேர்மத்தைத் தயாரிப்பதற்கான மாற்று வழிமுறைகள் தீவிரமாக ஆராயப்பட்டு வருகின்றன.
வினைகள்
தொகுஅறுகுளோரோபிளாட்டினிக் அமிலத்தைச் சூடாக்கும்போது முதலில் பிளாட்டினம்(VI) குளோரைடாகச் சிதைவடைகிறது. இந்த காரணத்தால்தான் அறுகுளோரோபிளாட்டினிக் அமிலத்தைச் சூடாக்கும்போது கரையாத பிளாட்டினம் சேர்மங்கள் தோன்றுகின்றன.[1]
- (H3O)2PtCl6·n H2O → PtCl4 + 2 HCl + (n + 2) H2O
பயன்கள்
தொகுபொட்டாசியம் உறுதிப்படுத்தல்
தொகுபொட்டாசியத்தை உறுதிப்படுத்தும் சோதனையில் குளோரோபிளாட்டினிக் அமிலம் தனித்துவம் மிக்கதாக உள்ளது. இச்சோதனையில் பொட்டாசியம் குறிப்பாக பொட்டாசியம் குளோரோபிளாட்டினேட்டாக வீழ்படிவாகிறது. 85 சதவீத ஆல்ககால் கரைசல்களில் மிகையளவு பிளாட்டினேட்டு அயனிகளுடன் உறுதிப்படுத்தல்கள் மேற்கொள்ளப்பட்டு வீழ்படிவானது எடையிடப்படுகிறது. இதன்மூலம் 0.02 முதல் 0.2 சதவீதம் (மோலார்/பருமன்) வரையான அடர்த்தி அளவுடன் பொட்டாசியத்தை உறுதிப்படுத்தலாம்.[4]
பிளாட்டினம் தூய்மைப்படுத்தல்
தொகுஅமோனியம் குளோரைடு போன்ற அமோனியம் உப்புகளுடன் சேர்த்து சூடுபடுத்தும்போது அமோனியம் அறுகுளோரோபிளாட்டினேட்டு வீழ்படிவாகிறது.[3] இவ்வுப்பை ஐதரசனுடன் சேர்த்து சூடாக்கி ஒடுக்குதல் வினைக்கு உட்படுத்தினால் தனிமநிலை பிளாட்டினம் கிடைக்கிறது. பெரும்பாலும் பிளாட்டினம் அதன் தாதுக்களில் இருந்து இம்முறையிலேயே பிர்த்தெடுக்கப்படுகிறது.[5]
வினையூக்கம்
தொகுபல பிளாட்டினம் சேர்மங்களைப் போலவே குளோரோபிளாட்டினிக் அமிலமும் வினையூக்கியாகப் பயன்படுத்தப்படுகிறது. முதன்முதலில், தௌ கார்னிங் என்ற அமெரிக்க பன்னாட்டு நிறுவனத்தைச் சார்ந்த சான் சுபீயர் மற்றும் உடனிணை பணியாளர்கள் சிலைல் ஐதரைடுகளுடன் ஒலிபீன்களைச் சேர்க்கும் ஐதரோசிலைலேற்ற வினையில் இச்சேர்மத்தை வினையூக்கியாகப் பயன்படுத்தினர். குறிப்பாக முக்குளோரோ சிலேன் (SiHCl3) மற்றும் மெத்தில் இருகுளோரோசிலேன் கலந்த சமபுரொப்பனால் (CH3HSiCl2) கரைசல்களை பென்டீன்களுடன் சேர்த்து சுபீயர் பயன்படுத்தினார். முன்னதாக சிலேன்களை ஆல்க்கீன்களுடன் சேர்ப்பதற்கு தனியுறுப்பு வினைகள் தேவைப்பட்டன. ஆனால் அவை திறன்மிக்க முறைகளாக இல்லை[6][7] . பொதுவாக, குளோரோபிளாட்டினிக் அமிலம் அசலான வினையூக்கிகளுக்கு ஒரு முன்னோடியாகக் கருதப்படுகிறது.
தொடர்புடைய சேர்மங்கள்
தொகுஇராச திராவகத்தின் உதவியுடன் தயாரிக்கப்படும் குளோரோபிளாட்டினிக் அமிலம் சில சமயங்களில் நைட்ரசோனியம் அறுகுளோரோ பிளாட்டினேட்டு (NO)2PtCl6) சேர்மம் கலந்து தூய்மைக்கேடு அடைகிறது. நைட்ரோசில் குளோரைடுடன் பிளாட்டினத்தைச் சேர்ப்பதன் மூலம் நைட்ரசோனியம் அறுகுளோரோ பிளாட்டினேட்டு தயாரிக்கமுடியும்.[8]
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 A. E. Schweizer, G. T. Kerr (1978). "Thermal Decomposition of Hexachloroplatinic Acid". Inorg. Chem. 17 (8): 2326–2327. doi:10.1021/ic50186a067.
- ↑ Holleman, Wiberg (2001). Inorganic Chemistry (First ed.). New York: Academic Press. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
- ↑ 3.0 3.1 George B. Kauffman (1967). "Ammonium Hexachloroplatinate(IV)". Inorganic Syntheses 9: 182–185. doi:10.1002/9780470132401.ch51.
- ↑ G. F. Smith, J. L. Gring (1933). "The Separation and Determination of the Alkali Metals Using Perchloric Acid. V. Perchloric Acid and Chloroplatinic Acid in the Determination of Small Amounts of Potassium in the Presence of Large Amounts of Sodium". J. Am. Chem. Soc. 55 (10): 3957–3961. doi:10.1021/ja01337a007.
- ↑ Cotton, S. A. Chemistry of Precious Metals, Chapman and Hall (London): 1997. பன்னாட்டுத் தரப்புத்தக எண் 0-7514-0413-6.
- ↑ J. L. Speier, J. A. Webster, G. H. Barnes (1957). "The Addition of Silicon Hydrides to Olefinic Double Bonds. Part II. The Use of Group VIII Metal Catalysts". J. Am. Chem. Soc. 79 (4): 974–979. doi:10.1021/ja01561a054.
- ↑ John C. Saam, John L. Speier (1958). "The Addition of Silicon Hydrides to Olefinic Double Bonds. Part III. The Addition to Non-terminal Olefins in the Presence of Chloroplatinic Acid". J. Am. Chem. Soc. 80 (15): 4104–4106. doi:10.1021/ja01548a073.
- ↑ R. T. Moravek, G. B. Kauffman and T. Mahmood (1967). "Nitrosyl Hexachloroplatinate(IV)". Inorganic Syntheses 9: 217–220. doi:10.1002/9780470132555.ch63.