சோடியம் குரோமேட்டு
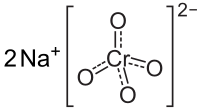
சோடியம் குரோமேட்டு (Sodium chromate) என்பது Na2CrO4 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். மஞ்சள் நிறத்துடன் நீருறிஞ்சும் திண்மமாகக் காணப்படும் இச்சேர்மத்தால் நான்கு, ஆறு மற்றும் பத்து நீரேற்றுகளாக உருவாக முடியும். தாதுக்களில் இருந்து குரோமியத்தைப் பிரித்தெடுக்கும்போது ஒரு இடைநிலைப் பொருளாக சோடியம் குரோமேட்டு உருவாகிறது. பிற ஆறு இணைதிறன் குரோமியம் சேர்மங்களைப் போல இச்சேர்மமும் நச்சுத்தன்மையுடனும் புற்றுநோய் ஊக்கியாகவும் செயல்படுகிறது.[1]
| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
சோடியம் குரோமேட்டு
| |
| வேறு பெயர்கள்
குரோமிக் அமிலம், (Na2CrO4), இருசோடியம் உப்பு
குரோமியம் இருசோடியம் ஆக்சைடு ராகுரோமேட்டு | |
| இனங்காட்டிகள் | |
| 7775-11-3 | |
| ChEBI | CHEBI:78671 |
| EC number | 231-889-5 |
InChI
| |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24488 |
| வே.ந.வி.ப எண் | GB2955000 |
| |
| UN number | 3288 |
| பண்புகள் | |
| Na2CrO4 | |
| வாய்ப்பாட்டு எடை | 161.97 கி/மோல் |
| தோற்றம் | மஞ்சள் நிறப் படிகங்கள் |
| மணம் | நெடியற்றது |
| அடர்த்தி | 2.698 கி/செ.மீ3 |
| உருகுநிலை | 792 °C (1,458 °F; 1,065 K) (நீரிலி) 20 °செ (பதின்நீரேற்று) |
| 31.8 கி/100 மி.லி (0 °செ) 84.5 கி/100 மி.லி (25 °செ) 126.7 கி/100 மி.லி (100 °செ) | |
| கரைதிறன் | எத்தனால் கரைப்பானில் சிறிதளவு கரையும் |
| மெத்தனால்-இல் கரைதிறன் | 0.344 கி/100 மி.லி (25 °செ) |
| கட்டமைப்பு | |
| படிக அமைப்பு | சாய்சதுரம் (413 °செ வெப்பநிலைக்கு மேல் அறுகோணம்) |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
−1329 கி.யூ/மோல் |
| நியம மோலார் எந்திரோப்பி S |
174.5 யூ/மோல் கெ |
| வெப்பக் கொண்மை, C | 142.1 யூ/மோல் கெ |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 1370 |
| ஈயூ வகைப்பாடு | புற்றுநோய். Cat. 2 அதிக நச்சு (T+) தீங்கு (Xn) அரிப்புத்தன்மை (C) சுற்றுச்சூஅலுக்கு அபாயமானது (N) |
| R-சொற்றொடர்கள் | R45, R46, R60, R61, R21, R25, R26, R34, R42/43, R48/23, R50/53 |
| S-சொற்றொடர்கள் | S53, S45, S60, S61 |
| தீப்பற்றும் வெப்பநிலை | எள்தில் தீப்பற்றாது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | சோடியம் இருகுரோமேட்டு சோடியம் மாலிப்டேட்டு சோடியம் தங்குதேட்டு |
| ஏனைய நேர் மின்அயனிகள் | பஒட்டாசியம் குரோமேட்டு கால்சியம் குரோமேட்டு பேரியம் குரோமேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு முறை
தொகுசோடியம் கார்பனேட்டு முன்னிலையில் குரோமியம் தாதுக்களை காற்றில் வறுக்கும் போது சோடியம் குரோமேட்டைப் பெருமளவில் தயாரிக்க முடியும்.
Cr2O3 + 2 Na2CO3 + 3/2 O2 → 2 Na2CrO4 + 2 CO2
இரும்பு ஆக்சைடுகளில் இருந்து பிரித்து, தண்ணீரால் பிரித்தெடுக்க இயலும் குரோமியமாக மாற்ற இச்செயல்முறை உதவுகிறது. இவ்வாறு பிரித்தெடுக்கப்பட்டவுடன் குரோமேட்டு உப்பு அடுத்ததாக சோடியம் இருகுரோமேட்டு உப்பாக மாற்றப்படுகிறது. இவ்வுப்பே பெரும்பாலான குரோமியம் சேர்மங்கள் தயாரிப்பதற்கான முன்னோடிச் சேர்மமாகும். தொழிற்சாலைகளில் குரோமியம் ஆக்சைடை சோடியம் குரோமேட்டுடன் கந்தகம் சேர்த்து தயாரிக்கிறார்கள்.
அமிலக் காரப் பண்புகள்
தொகுஅமிலங்களுடன் சேர்த்து வினைப்படுத்தும்போது சோடியம் குரோமேட்டு, சோடியம் இருகுரோமேட்டாக மாற்றப்படுகிறது.
2 Na2CrO4 + 2 H+ → + H2O + Na2Cr2O7
கூடுதலாக அமிலம் சேர்க்கும் அமிலமாக்கல் வினையின் போது குரோமியம் மூவாக்சைடைத் தருகிறது.
Na2CrO4 + H2SO4 → CrO3 + Na2SO4 + H2O
பயன்கள்
தொகுகுரோமியத்தை அதன் தாதுக்களில் இருந்து பிரித்தெடுப்பதில் மிகமுக்கியப் பங்கு வகிக்கிறது என்பதைத் தவிர்த்து, பெட்ரொலியத் தொழிற்சாலைகளில் சோடியம் குரோமேட்டு அரிமானத் தடுப்பியாகப் பயனாகிறது.[1] நெசவுத் தொழிற்சாலைகளில் சாயமேற்றும் துணைப்பொருளாகவும், மரச்சாமான்கள் பாதுகாப்பிலும் பயன்படுகிறது.[1] and a wood preservative.[2] இரத்தச் சிவப்பு அணுக்களின் கன அளவை உறுதிப்படுத்தும் மருந்துப் பொருளாகவும் நோயறியும் மருந்தியலில் பயன்படுகிறது.[3]
கரிம வேதியியலில், முதன்மை ஆல்ககால்களை கார்பாக்சிலிக் அமிலங்களாகவும், இரண்டாம் நிலை ஆல்ககால்களை கீட்டோன்களாகவும் மாற்றுவதில் ஆக்சிசனேற்றியாகவும் பயன்படுகிறது.[4]
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 1.2 Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger (2005), "Chromium Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, எண்ணிம ஆவணச் சுட்டி:10.1002/14356007.a07_067
{{citation}}: CS1 maint: multiple names: authors list (link) - ↑ "Sodium chromate - Pesticide use statistics for 2005". PAN Pesticides Database. பார்க்கப்பட்ட நாள் 2008-06-20.
- ↑ Bracco Diagnostics Inc. "chromitope sodium (Sodium Chromate, Cr 51) injection, solution". DailyMed. பார்க்கப்பட்ட நாள் 2008-06-20.
- ↑ Louis F. Fieser "Δ4-cholesten-3,6-dione" Org. Synth. 1955, 35, 36. எஆசு:10.15227/orgsyn.035.0036
உசாத்துணை
தொகு- "Sodium chromate". inchem. பார்க்கப்பட்ட நாள் 2008-06-20.
- Record of Sodium chromate in the GESTIS Substance Database of the Institute for Occupational Safety and Health