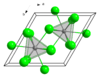
பிரசியோடைமியம்(III) குளோரைடு
பிரசியோடைமியம்(III) குளோரைடு (Praseodymium(III) chloride) என்பது PrCl3 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். மற்ற இலந்தனைடு முக்குளோரைடுகளைப் போலவே, இதுவும் நீரற்ற மற்றும் நீரேற்று வடிவங்களில் காணப்படுகிறது. நீல-பச்சை நிறத்தில் திண்மப் பொருளாக இருக்கும் இச்சேர்மம் ஈரமான காற்றில் வெளிப்படும் போது தண்ணீரை விரைவாக உறிஞ்சி வெளிர் பச்சை நிற எழுநீரேற்றை உருவாக்குகிறது.

| |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
பிரசியோடைமியம்(III) குளோரைடு
| |||
| வேறு பெயர்கள்
பிரசியோடைமியம் குளோரைடு; பிரசியோடைமியம் முக்குளோரைடு
| |||
| இனங்காட்டிகள் | |||
| 10361-79-2 | |||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 66317 | ||
| |||
| UNII | [http://fdasis.nlm.nih.gov/srs/srsdirect.jsp?regno=1JB99PM4G8
| ||
| பண்புகள் | |||
| PrCl3 | |||
| வாய்ப்பாட்டு எடை | 247.24 கி/மோல் (நீரிலி) 373.77 கி/மோல் (எழுநீரேற்று) | ||
| தோற்றம் | நீலப் பச்சை திண்மம் (நீரிலி) இளம் பச்சை திண்மம் (எழுநீரேற்று) | ||
| அடர்த்தி | 4.02 கி/செ.மீ3 (நீரிலி) 2.250 கி/செ.மீ3 (எழுநீரேற்று) | ||
| உருகுநிலை | 786 °C (1,447 °F; 1,059 K) | ||
| கொதிநிலை | 1,710 °C (3,110 °F; 1,980 K) | ||
| 104.0 கி/100 மி.லி (13 °செல்சியசு) | |||
| +44.5·10−6செ.மீ3/மோல் | |||
| கட்டமைப்பு | |||
| படிக அமைப்பு | அறுகோணம் (UCl3 type), hP8 | ||
| புறவெளித் தொகுதி | P63/m, எண். 176 | ||
| ஒருங்கிணைவு வடிவியல் |
மூவுச்சி முக்கோணப் பட்டகம் ஒன்பது ஒருங்கிணைப்புகள்) | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | எரிச்சலூட்டும் | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | பிரசியோடைமியம்(III) ஆக்சைடு, பிரசியோடைமியம்(III) புளோரைடு பிரசியோடைமியம்(III) புரோமைடு பிரசியோடைமியம் அயோடைடு | ||
| ஏனைய நேர் மின்அயனிகள் | சீரியம்(III) குளோரைடு நியோடிமியம்(III) குளோரைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
தயாரிப்பு
தொகுபிரசியோடைமியத்துடன் ஐதரசன் குளோரைடைச் சேர்த்து வினைபுரியச் செய்தால் பிரசியோடைமியம்(III) குளோரைடு உருவாகும்:[1][2]
- 2 Pr + 6 HCl → 2 PrCl3 + 3 H2.
பிரசியோடைமியம்(III) குளோரைடு பொதுவாக வெற்றிடப் பதங்கமாதல் மூலம் சுத்திகரிக்கப்படுகிறது.[3]
பிரசியோடைமியம்(III) குளோரைடின் நீரேற்றப்பட்ட உப்புகளை பிரசியோடைமியம் உலோகம் அல்லது பிரசியோடைமியம்(III) கார்பனேட்டை ஐதரோகுளோரிக் அமிலத்துடன் சேர்த்து சூடுபடுத்துவதன் மூலம் தயாரிக்கலாம்:
- Pr2(CO3)3 + 6 HCl + 15 H2O → 2 [Pr(H2O)9]Cl3 + 3 CO2
PrCl3∙7H2O ஒரு நீருறிஞ்சும் பொருளாகும். ஈரமுலர்த்தியில் உலர்த்தப்படும்வரை இது படிகமாக மாறாது. அம்மோனியம் குளோரைடு பாதை என்று அழைக்கப்படும் அம்மோனியம் குளோரைடு முன்னிலையில் 400 °செல்சியசு வெப்பநிலையில் நீரேற்றை வெப்ப நீரிழப்பு செய்வதன் மூலம் நீரிலி பிரசியோடைமியம்(III) குளோரைடை உருவாக்கலாம்.[3][4][5] மாறாக நீரேற்றை தயோனைல் குளோரைடைப் பயன்படுத்தியும் நீர்நீக்கம் செய்யலாம்.[3][6]
வினைகள்
தொகுபிரசியோடைமியம்(III) குளோரைடு இலூயிசு அமிலமாகும். கடின மற்றும் மென்மையான (இலூயிசு) அமிலங்கள் மற்றும் காரங்கள் கோட்பாட்டின் படி இது கடினமானது என வகைப்படுத்தப்படுகிறது. நீரேற்றை விரைவாக சூடுபடுத்தினால் சிறிய அளவிலான நீராற்பகுப்பை ஏற்படுத்தும்.[3] பிரசியோடைமியம்(III) குளோரைடானது பொட்டாசியம் குளோரைடுடன் வினைபுரிவதன் மூலம் ஒரு நிலையான இலூயிசு அமில-கார அணைவு (K2PrCl5) சேர்மத்தை உருவாக்குகிறது. இச்சேர்மம் சுவாரசியமான ஒளியியல் மற்றும் காந்தப் பண்புகளை காட்டுகிறது.[1]
கரையாத பிரசியோடைமியம்(III) சேர்மங்களைத் தயாரிக்க பிரசியோடைமியம்(III) குளோரைடின் நீர் கரைசல்களைப் பயன்படுத்தலாம். எடுத்துக்காட்டாக, பிரசியோடைமியம்(III) பாசுபேட்டு மற்றும் பிரசியோடைமியம்(III) புளோரைடு உப்புகளை முறையே பொட்டாசியம் பாசுபேட்டு மற்றும் சோடியம் புளோரைடு ஆகியவற்றுடன் வினை புரியச் செய்வதன் மூலம் தயாரிக்கலாம்:
- PrCl3 + K3PO4 → PrPO4 + 3 KCl
- PrCl3 + 3 NaF → PrF3 + 3 NaCl
- 2PrCl3 + 3 Na2CO3----> Pr2CO3 + 6NaCl
கார உலோக குளோரைடுகளுடன் சேர்த்து சூடாக்கப்படும் போது MPr2Cl7, M3PrCl6, M2PrCl5, and M3Pr2Cl9 இங்குள்ள M = K, Rb, Cs.[7] ஆகிய மூலக்கூற்று வாய்ப்பாடுகளைக் கொண்ட மும்மை (மூன்று வெவ்வேறு கூறுகளைக் கொண்ட சேர்மங்கள்) பொருட்களை உருவாக்குகிறது.
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 J. Cybinska; J. Sokolnicki; J. Legendziewicz; G. Meyer (2002-07-17). "Spectroscopic and magnetic studies of the ternary praseodymium chloride K2PrCl5". Journal of Alloys and Compounds 341: 115–123. doi:10.1016/S0925-8388(02)00089-0. https://www.semanticscholar.org/paper/Spectroscopic-and-magnetic-studies-of-the-ternary-Cybi%C5%84ska-Sokolnicki/2af96eacdd78d2ec04ac3c0342ca6d875f76130e.
- ↑ L.F. Druding; J.D. Corbett (1961-06-01). "Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide". J. Am. Chem. Soc. 83 (11): 2462-2467. doi:10.1021/ja01472a010. https://pubs.acs.org/doi/10.1021/ja01472a010.
- ↑ 3.0 3.1 3.2 3.3 F.T. Edelmann; P. Poremba (1997). Synthetic Methods of Organometallic and Inorganic Chemistry. Vol. 6. Stuttgart: Georg Thieme Verlag. பன்னாட்டுத் தரப்புத்தக எண் 978-31-319-3921-0.
- ↑ M.D. Taylor; P.C. Carter (April 1962). "Preparation of anhydrous lanthanide halides, especially iodides". J. Inorg. Nucl. Chem. 24 (4): 387-391. doi:10.1016/0022-1902(62)80034-7. https://www.sciencedirect.com/science/article/abs/pii/0022190262800347.
- ↑ J. Kutscher; A. Schneider (September 1971). "Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden" (in de). Inorg. Nucl. Chem. Lett. 7 (9): 815-819. doi:10.1016/0020-1650(71)80253-2. https://www.sciencedirect.com/science/article/abs/pii/0020165071802532.
- ↑ J.H. Freeman; M.L. Smith (October 1958). "The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride". J. Inorg. Nucl. Chem. 7 (3): 224-227. doi:10.1016/0022-1902(58)80073-1. https://www.sciencedirect.com/science/article/abs/pii/0022190258800731.
- ↑ Gerd Meyer (1990). "Ternary Chlorides and Bromides of the Rare-Earth Elements". Inorganic Syntheses 30: 72–81. doi:10.1002/9780470132616.ch15.
மேலும் வாசிக்க
தொகு- CRC Handbook of Chemistry and Physics (58th edition), CRC Press, West Palm Beach, Florida, 1977.
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, 1984.
- S. Sugiyama, T. Miyamoto, H. Hayashi, M. Tanaka, J. B. Moffatt, "Effects of chlorine additives in the gas- and solid-phases on the oxidative dehydrogenation of ethane over praseodymium oxide", Journal of Molecular Catalysis A, 118, 129-136 (1997).
- Druding L. F.; Corbett J. D.; Ramsey B. N. (1963). "Rare Earth Metal-Metal Halide Systems. VI. Praseodymium Chloride". Inorganic Chemistry 2 (4): 869–871. doi:10.1021/ic50008a055.