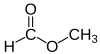
மீத்தைல் பார்மேட்டு
மீத்தைல் பார்மேட் ( Methyl formate ) என்பது மீத்தைல் மெத்தனோயேட்டு என்றும் அழைக்கப்படும் ஒரு எசுத்தர் ஆகும். பார்மிக் அமிலத்தினுடைய மிக எளிய எசுத்தருக்கு எடுத்துக்காட்டு மீத்தைல் எசுத்தராகும். நிறமற்ற திரவமாகவும் மெல்லிய எத்தில் மணமும் உயர் ஆவியழுத்தமும், குறைந்த பரப்பு இழுவிசையும் கொண்டு ஏராளமான சேர்மங்களை வணிகமுறையில் தயாரிப்பதற்கு முன்னோடியாக மீத்தைல் பார்மேட் விளங்குகிறது[1]
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
மீத்தைல் மெத்தனோயேட்டு
| |||
| வேறு பெயர்கள்
R-611
| |||
| இனங்காட்டிகள் | |||
| 107-31-3 | |||
| ChEBI | CHEBI:77699 | ||
| ChEMBL | ChEMBL295026 | ||
| ChemSpider | 7577 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 7865 | ||
| |||
| பண்புகள் | |||
| C2H4O2 | |||
| வாய்ப்பாட்டு எடை | 60.05 g·mol−1 | ||
| தோற்றம் | நிறமற்ற திரவம் | ||
| அடர்த்தி | 0.98 g/cm³ | ||
| உருகுநிலை | −100 °C (−148 °F; 173 K) | ||
| கொதிநிலை | 32 °C (90 °F; 305 K) | ||
| தீங்குகள் | |||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | Oxford MSDS | ||
| ஈயூ வகைப்பாடு | சுடருடன் எரியக்கூடியது (F+); தீங்கானது (Xn) | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
தயாரிப்பு
தொகுமெத்தனால் மற்றும் பார்மிக் அமிலத்தினுடைய ஒடுக்க வினையின் விளைவாக மீத்தைல் பார்மேட்டை ஆய்வகத்தில் தயாரிக்க இயலும்.
பொதுவாக தொழிற்சாலைகளில் சோடியம் மீத்தாக்சைடு போன்ற ஒரு வலிமையான காரத்தின் முன்னிலையில் மெத்தனாலை கார்பன் மோனாக்சைடுடன் சேர்த்து பெருமளவில் தயாரிக்கிறார்கள்:[2].
- CH3OH + CO → HCO2CH3
இச்செயல்முறையை பி.எ.எசு.எப் என்ற வேதித் தொழிற்சாலை நிறுவனம் மற்ற நிறுவனங்களைவிட அதிகமாக 96 சதவீதம் அளவுக்கு இம்முறையைத் தேர்ந்தெடுக்கிறது. இச்செயல்முறைக்கு வினையூக்கியாக உலர் கார்பன் மோனாக்சைடு, வாயுத் தொகுப்பு முறையில் தயாரிக்கப்பட்டு நீரற்ற நிலையில் உள்ள கார்பன் மோனாக்சைடாக இங்கு பயன்படுத்தப்படுகிறது[3]
பயன்கள்
தொகுபார்மமைடு, டைமெத்தில் பார்மமைடு மற்றும் பார்மிக் அமிலம் முதலான சேர்மங்களைத் தயாரிப்பதற்கு மீத்தைல் பார்மேட் முதன்மையான பகுதிப்பொருளாக உள்ளது. இச்சேர்மங்கள் யாவும் பல்வேறு வேதிப்பொருட்களைத் தயாரிப்பதற்கான முன்னோடிகள் அல்லது அடிப்படைப் பொருட்கள் என்பது குறிப்பிடத்தக்கது. இதனுடைய உயர் ஆவியழுத்தம் காரணமாக சிறந்த உலர்த்தியாக பயன்படுத்தப்படுகிறது. பல்வேறு வகையான பாலியூரெத்தேன்கள் தயாரிப்பில் இது பயனாகிறது. குளோரோபுளோரோகார்பன் சேர்மத்திற்கு மாற்றாக இதனை பயன்படுத்தலாம். குறைந்த ஓசோன், குறைந்த புவிவெப்பமயமாதல் விளைவு , எளிதில் ஆவியாகாத கரிமச் சேர்மம்[4] ஆகிய சிறப்பம்சங்கள் கொண்ட இது ஒரு பூச்சிக்கொல்லியாகவும் உபயோகப்படுகிறது.
குளிர்சாதனப் பெட்டிகளில் மீத்தைல் பார்மேட்டின் பயன்பாடுதான் வரலாற்று முக்கியத்துவம் வாய்ந்த பயன்பாடுகளில் ஒன்றாகக் கருதப்படுகிறது. குறைந்த நச்சுத்தன்மை கொண்ட குளிர்பதனப்பொருட்களின் அறிமுகத்திற்கு முன்பு வீட்டுபயோக குளிர்பதனிகளில் கந்தக டைஆக்சைடிற்கு மாற்றாக மீத்தைல் பார்மேட்டு பெரும்பங்கு வகித்தது.
மேற்கோள்கள்
தொகு- ↑ Werner Reutemann and Heinz Kieczka "Formic Acid" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. எஆசு:10.1002/14356007.a12_013
- ↑ Process Economics Reports, Review 88-1-1, Process Economics Program, SRI Consulting, California, 1999
- ↑ W. Couteau, J. Ramioulle, US Patent US4216339
- ↑ United Nations Environment Program Rigid and Flexible Foams Technical Options Committee 2006 Assessment report. http://ozone.unep.org/teap/Reports/FTOC/ftoc_assessment_report06.pdf பரணிடப்பட்டது 2011-07-21 at the வந்தவழி இயந்திரம்