ஆஃபினியம் டெட்ராகுளோரைடு
ஆஃபினியம் டெட்ராகுளோரைடு (Hafnium tetrachloride) என்பது HfCl4 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். இந்த நிறமற்ற திடப்பொருளானது பெரும்பாலான ஆஃபினியம் கரிமவுலோகச் சேர்மங்கள் தயாரிப்பதற்குப் பயன்படும் ஓரு முன்னோடிச் சேர்மமாகும். இச்சேர்மம் பல்வேறு சிறப்பு வாய்ந்த பயன்பாடுகளைக் கொண்டுள்ளது, முக்கியமாக பொருள் அறிவியலிலும் ஒரு வினையூக்கியாகவும் அதிகமாகப் பயன்படுகிறது.
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
ஆஃபினியம்(IV) குளோரைடு
ஆஃபினியம் டெட்ராகுளோரைடு | |
| இனங்காட்டிகள் | |
| 13499-05-3 | |
| ChemSpider | 34591 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 37715 |
| |
| UNII | CNZ9V5JM5H |
| பண்புகள் | |
| HfCl4 | |
| வாய்ப்பாட்டு எடை | 320.302 கி/மோல் |
| தோற்றம் | வெண்மையான படிகத் திண்மம் |
| அடர்த்தி | 3.89 கி/செ.மீ3[1] |
| உருகுநிலை | 432 °C (810 °F; 705 K) |
| சிதைவடையும்[2] | |
| ஆவியமுக்கம் | 1 மி.மிபாதரசம் 190 °செல்சியசு |
| கட்டமைப்பு | |
| படிக அமைப்பு | ஒற்றைச் சரிவச்சு, mP10[1] |
| புறவெளித் தொகுதி | C2/c, எண்o. 13 |
| Lattice constant | a = 0.6327 நானோ மீட்டர், b = 0.7377 நானோ மீட்டர், c = 0.62 நானோ மீட்டர் |
| ஒருங்கிணைவு வடிவியல் |
4 |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | அரிக்கும், எரிச்சலூட்டும் |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | MSDS |
| தீப்பற்றும் வெப்பநிலை | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
2362 மி.கி/கி.கி (எலி, வாய்வழி)[3] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | ஆஃபினியம் நான்குபுளோரைடு ஆஃபினியம் நாற்புரோமைடு ஆஃபினியம் நான்கையோடைடு |
| ஏனைய நேர் மின்அயனிகள் | தைட்டானியம் டெட்ராகுளோரைடு சிர்கோனியம்(IV) குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகுஆஃபினியம் டெட்ராகுளோரைடு தொடர்புடைய பல வேதிச் செயல்முறைகளால் தயாரிக்கப்படுகிறது:
- கார்பன் டெட்ராகுளோரைடு மற்றும் ஆஃபினியம்(IV) ஆக்சைடு ஆகிய சேர்மங்கள் 450°செல்சியசு வெப்பநிலைக்குமேல் வினைபுரிவதால் ஆஃபினியம் டெட்ராகுளோரைடு உருவாகிறது. [4][5]
- HfO2 + 2 CCl4 → HfCl4 + 2 COCl2
- குளோரின் வாயு அல்லது இருகந்தக இருகுளோரைடு முன்னிலையில் HfO2 மற்றும் கல்கரி சேர்ந்த கலவையை 600° செல்சியசு வெப்பநிலைக்கு மேல் குளோரினேற்றம் செய்தும் இதை தயாரிக்கலாம்:[6][7]
- HfO2 + 2 Cl2 + C → HfCl4 + CO2
- ஆஃபினியம் கார்பைடை 250° செல்சியசு வெப்பநிலைக்கு மேல் குளோரினேற்றம் செய்தும் இதை தயாரிக்கலாம்.[8]
ஆஃபினியம் மற்றும் சிர்க்கோனியம் பிரித்தெடுத்தல்
தொகுஆஃபினியம் மற்றும் சிர்க்கோனியம் ஆகியவை சிர்கோன், சிர்டோலைட்டு மற்றும் பேத்தலைட்டு போன்ற தாதுக்களில் ஒன்றாகக் காணப்படுகின்றன. சிர்கோனில் 0.05% முதல் 2.0% வரை ஆஃபினியம் டை ஆக்சைடு (HfO2) கலந்துள்ளது. 5.5% முதல் 17% HfO2 வரை சிர்டோலைட்டு கனிமத்திலும் பேத்தலைட்டில் 1.0 முதல் 1.8 சதவீதம் வரையிலும் HfO2 உள்ளது. [9] ஆஃபினியம் மற்றும் சிர்க்கோனியம் சேர்மங்கள் இரண்டும் தாதுக்களிலிருந்து ஒன்றாக பிரித்தெடுக்கப்பட்டு டெட்ராகுளோரைடுகளின் கலவையாக மாற்றப்படுகின்றன.
HfCl4 மற்றும் ZrCl4 சேர்மங்களைப் பிரிப்பது கடினம், ஏனெனில் Hf மற்றும் Zr சேர்மங்கள் மிகவும் ஒத்த இரசாயன மற்றும் இயற்பியல் பண்புகளைக் கொண்டுள்ளன. இவற்றின் அணு ஆரங்கள் ஒரே மாதிரியானவை: ஆஃபினியத்தின் அணு ஆரம் 156.4 பைக்கோமீட்டர், சிர்க்கோனியத்தின் அணு ஆரம் 160 பைக்கோமீட்டர் ஆகும்.[10] இந்த இரண்டு உலோகங்களும் ஒரே மாதிரியான வேதி வினைகளுக்கு உட்பட்டு ஒரே மாதிரியான ஒருங்கிணைப்புச் சேர்மங்களை உருவாக்குகின்றன.
ZrCl4 சேர்மத்திலிருந்து HfCl4 சேர்மத்தை பிரித்து சுத்திகரிக்க பல செயல்முறைகள் முன்மொழியப்பட்டுள்ளன. பகுதியளவு வடிகட்டுதல், பகுதியளவு வீழ்படிவாக்கம் , பகுதியளவு படிகமயமாக்கல் மற்றும் அயனி பரிமாற்றம் ஆகிய செயல்முறைகள் இதில் அடங்கும். திண்ம ஆஃபினியம் குளோரைடின் (476 முதல் 681 கெல்வின் வரை) நீராவி அழுத்தத்தின் பதிவு (மடக்கை 10) சமன்பாட்டின் மூலம் வழங்கப்படுகிறது: மடக்கை10 P = -5197/வெப்பம் + 11.712. இங்கு அழுத்தம் டார்சிலும் வெப்பநிலை கெல்வின்களிலும் அளவிடப்படுகிறது. (உருகுநிலையில் அழுத்தம் 23,000 டார்சு ஆகும்.)[11]
இரண்டு டெட்ரா ஆலைடுகளுக்கு இடையே உள்ள குறைப்புத்தன்மையின் வேறுபாட்டை அடிப்படையாகக் கொண்டது ஒரு முறையாகும். சிர்க்கோனியம் சேர்மத்தை ஒன்று அல்லது அதற்கு மேற்பட்ட குறைந்த ஆலைடுகளாக அல்லது சிர்க்கோனியமாகக் குறைப்பதன் மூலம் டெட்ரா ஆலைடுகளைப் பிரிக்கலாம். ஆஃபினியம் டெட்ராகுளோரைடு குறைப்பின் போது கணிசமாக மாறாமல் இருக்கும். சிர்க்கோனியம் துணை ஆலைடுகளிலிருந்து உடனடியாக இதை மீட்டெடுக்கலாம். ஆஃபினியம் டெட்ராகுளோரைடு ஆவியாகும் தன்மை உடையது, எனவே ஆவியாகாத சிர்க்கோனியம் டிரை ஆலைடிலிருந்து எளிதாகப் பிரிக்கலாம்.
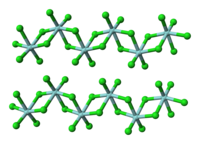
கட்டமைப்பும் பிணைப்பும்
தொகுஇந்த குழு 4 ஆலைடில் +4 என்ற ஆக்சிசனேற்ற நிலையில் ஆஃபினியம் உள்ளது. திண்ம HfCl4 எண்முக Hf மையங்களைக் கொண்ட ஒரு பலபடி ஆகும். ஒவ்வொரு Hf மையத்தைச் சுற்றியுள்ள ஆறு குளோரைடு ஈந்தணைவிகளில் இரண்டு குளோரைடு ஈந்தணைவிகள் முனையமாகவும், நான்கு மற்றொரு Hf மையத்திற்கு பாலமாகவும் இருக்கும். வாயு கட்டத்தில், ZrCl4 மற்றும் HfCl4 இரண்டும் TiCl4 சேர்மத்திற்கு காணப்படும் மோனோமெரிக் நான்முகி கட்டமைப்பை ஏற்றுக்கொள்கின்றன. வாயு கட்டத்தில் HfCl4 சேர்மத்தின் மின்னணு தோற்றுருக் குழாய் ஆய்வுகள் Hf-Cl அணுக்கருக்களிடை தூரம் 2.33 Å என்றும், Cl...Cl அணுக்கருக்களிடை தூரம் 3.80 Å என்றும் காட்டியது. அணுக்கரு தூரங்களின் விகிதம் r(Me-Cl)/r(Cl...Cl) 1.630 மற்றும் இந்த மதிப்பு வழக்கமான நான்முகி மாதிரியின் (1.633) மதிப்புடன் நன்றாக ஒத்துப்போகிறது.[10]
வினைத்திறம்
தொகுஆஃபினியம் டெட்ராகுளோரைடு நீராற்பகுப்பிற்கு உட்பட்டு ஐதரசன் குளோரைடை வெளிவிடுகிறது:
- HfCl4 + H2O → HfOCl2 + 2 HCl
நாட்பட்ட மாதிரிகள் பெரும்பாலும் ஆக்சிகுளோரைடுகளால் மாசுபடுத்தப்படுகின்றன, இவை நிறமற்றவை. டெட்ரா ஐதரோ பியூரான் ஓர் ஓருறுப்பு 2:1 அணைவுச் சேர்மமாக உருவாகிறது.[13]
- HfCl4 + 2 OC4H8 → HfCl4(OC4H8)2
ஏனெனில் இந்த அணைவுச் சேர்மம் கரிம கரைப்பான்களில் கரையக்கூடியது என்பதால், ஆஃபினியத்தின் மற்ற அணைவுச் சேர்மங்களைத் தயாரிப்பதற்கு இது ஒரு பயனுள்ள வினையாக்கியாகும்.
HfCl4 கிரிக்கனார்டு வினையாக்கியுடன் உப்பு இடப்பெயர்ச்சி வினைக்கு உட்படுகிறது. இந்த வழிமுறையில் டெட்ராபென்சைல் ஆஃபினியத்தை தயாரிக்கலாம்.
- 4 C6H5CH2MgCl + HfCl4 → (C6H5CH2)4Hf + 4 MgCl2
இதேபோல், சோடியம் வளையபெண்டாடையீனைடுடன் உப்பு இடம்பெயரல் வினை ஆஃபினோசீன் டைகுளோரைடை அளிக்கிறது:
- 2 NaC5H5 + HfCl4 → (C5H5)2HfCl2 + 2 NaCl
ஆல்ககால்களுடன் வினை புரிந்து ஆல்காக்சைடுகள் உருவாகின்றன.
- HfCl4 + 4 ROH → Hf(OR)4 + 4 HCl
இந்த சேர்மங்கள் சிக்கலான கட்டமைப்புகளை ஏற்றுக்கொள்கின்றன.
ஒடுக்கம்
தொகுHfCl4 சேர்மத்தை ஒடுக்குவது மிகவும் கடினம். பாசுபீன் ஈந்தணைவிகளின் முன்னிலையில், பொட்டாசியம்-சோடியம் கலப்புலோகத்துடன் ஒடுக்கம் செய்ய இயலும்.:[14]
- 2 HfCl4 + 2 K + 4 P(C2H5)3 → Hf2Cl6[P(C2H5)3]4 + 2 KCl
ஆழ்ந்த பச்சை நிற ஈராஃபினியம் தயாரிப்பு எதிர்காந்தவியல்பு கொண்டதாகும். அணைவுச் சேர்மம் Zr ஒப்புமை போன்ற ஒரு விளிம்பு-பகிர்வு ஈரெண்முகக் கட்டமைப்பை ஏற்றுக்கொள்கிறது என்பதை X-கதிர் படிகவியல் காட்டுகிறது.
பயன்கள்
தொகுஆஃபினியம் டெட்ரா குளோரைடு என்பது ஆல்க்கீன்களின், குறிப்பாக புரோப்பிலீனின் சீக்லர்-நாட்டா பலபடியாக்கல் வினைக்கான மிகவும் செயலில் உள்ள வினையூக்கிகளுக்கு முன்னோடியாகும். வழக்கமான வினையூக்கிகள் டெட்ராபென்சைல் ஆஃபினியத்திலிருந்து பெறப்படுகின்றன.[15]
HfCl4 கரிமத் தொகுப்பு வினைகளில் பல்வேறு பயன்பாடுகளுக்கு பயனுள்ள இலூயிசு அமிலமாகும். எடுத்துக்காட்டாக, அலுமினியம் முக்குளோரைடுடன் ஒப்பிடும்போது ஆஃபினியம் குளோரைடைப் பயன்படுத்தி பெரோசீன் அல்லைல் டைமெத்தில் குளோரோசிலேனுடன் அல்கைலேற்றம் செய்யப்படுகிறது. Hf தனிமத்தின் பெரிய அளவு, பெரோசீனுக்கு சிக்கலான HfCl4 இன் போக்கைக் குறைக்கும்.[16]
HfCl4 1,3-இருமுனை வளையக்கூட்டு வினைகளின் வீதத்தையும் கட்டுப்பாட்டையும் அதிகரிக்கிறது.[17] குறிப்பிட்ட எக்சோ-மாற்றியம் உருவாக்கத்தை அனுமதிக்கும் அரைல் மற்றும் அலிபாட்டிக் அல்டாக்சைம்களுடன் பயன்படுத்தும்போது மற்ற இலூயிசு அமிலங்களை விட இது சிறந்த முடிவுகளைத் தருவதாகக் கண்டறியப்பட்டது.
நுண்மின்னணுவியல் பயன்பாடுகள்
தொகுஇரசாயன நீராவிப் படிவு மற்றும் ஆஃபினியம் டை ஆக்சைடு, ஆஃபினியம் சிலிக்கேட்டு ஆகியவற்றின் அணு அடுக்கு படிவுக்கான முன்னோடியாகக் கருதப்பட்டது. நவீன உயர்-அடர்த்தி ஒருங்கிணைந்த சுற்றுகளை தயாரிப்பதில் உயர்-கே மின் காப்புப் பொருளாகப் பயன்படுத்தப்படுகிறது.[18] இருப்பினும், ஒப்பீட்டளவில் குறைந்த ஆவியாகும் பண்பு மற்றும் அரிக்கும் துணை விளைபொருள்கள் (அதாவது, HCl), காரணமாக HfCl4 சேர்மமானது டெட்ராகிசு எத்தில்மெதிலமினோ ஆஃபினியம் (TEMAH) போன்ற உலோக-கரிம முன்னோடிகளால் படிப்படியாக வெளியேற்றப்பட்டது.[19]
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 Niewa R., Jacobs H. (1995) Z. Kristallogr. 210: 687
- ↑ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.66. பன்னாட்டுத் தரப்புத்தக எண் 1439855110.
- ↑ "Hafnium compounds (as Hf)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Kirk-Othmer Encyclopedia of Chemical Technology. Vol. 11 (4th ed.). 1991.
- ↑ Hummers, W. S.; Tyree, Jr., S. Y.; Yolles, S. (1953). Zirconium and Hafnium Tetrachlorides. Inorganic Syntheses. Vol. 4. p. 121. எண்ணிம ஆவணச் சுட்டி:10.1002/9780470132357.ch41. பன்னாட்டுத் தரப்புத்தக எண் 9780470132357.
- ↑ Hopkins, B. S. (1939). "13 Hafnium". Chapters in the chemistry of less familiar elements. Stipes Publishing. p. 7.
- ↑ Hála, Jiri (1989). Halides, oxyhalides and salts of halogen complexes of titanium, zirconium, hafnium, vanadium, niobium and tantalum. Vol. 40 (1st ed.). Oxford: Pergamon. pp. 176–177. பன்னாட்டுத் தரப்புத்தக எண் 978-0080362397.
- ↑ Elinson, S. V. and Petrov, K. I. (1969) Analytical Chemistry of the Elements: Zirconium and Hafnium. 11.
- ↑ Newnham, Ivan Edgar "Purification of Hafnium Tetrachloride". U.S. patent 29,61,293 November 22, 1960.
- ↑ 10.0 10.1 Spiridonov, V. P.; Akishin, P. A.; Tsirel'Nikov, V. I. (1962). "Electronographic investigation of the structure of zirconium and hafnium tetrachloride molecules in the gas phase". Journal of Structural Chemistry 3 (3): 311. doi:10.1007/BF01151485.
- ↑ Palko, A. A.; Ryon, A. D.; Kuhn, D. W. (1958). "The Vapor Pressures of Zirconium Tetrachloride and Hafnium Tetrachloride". The Journal of Physical Chemistry 62 (3): 319. doi:10.1021/j150561a017.
- ↑ Duraj, S. A.; Towns; Baker; Schupp, J. (1990). "Structure of cis-Tetrachlorobis(tetrahydrofuran)hafnium(IV)". Acta Crystallographica C46 (5): 890–2. doi:10.1107/S010827018901382X.
- ↑ Manzer, L. E. (1982). "Tetrahydrofuran Complexes of Selected Early Transition Metals". Inorg. Synth. 21: 135–140. doi:10.1002/9780470132524.ch31. பன்னாட்டுத் தரப்புத்தக எண்:978-0-470-13252-4.
- ↑ Riehl, M. E.; Wilson, S. R.; Girolami, G. S. (1993). "Synthesis, X-ray Crystal Structure, and Phosphine-Exchange Reactions of the Hafnium(III)-Hafnium(III) Dimer Hf2Cl6[P(C2H5)3]4". Inorg. Chem. 32 (2): 218–222. doi:10.1021/ic00054a017.
- ↑ Ron Dagani (2003-04-07). "Combinatorial Materials: Finding Catalysts Faster". Chemical and Engineering News: pp. 10. http://pubs.acs.org/cen/topstory/8114/print/8114notw5.html.
- ↑ Ahn, S.; Song, Y. S.; Yoo, B. R.; Jung, I. N. (2000). "Lewis Acid-Catalyzed Friedel−Crafts Alkylation of Ferrocene with Allylchlorosilanes". Organometallics 19 (14): 2777. doi:10.1021/om0000865.
- ↑ Graham, A. B.; Grigg, R.; Dunn, P. J.; Higginson, P. (2000). "Tandem 1,3-azaprotiocyclotransfer–cycloaddition reactions between aldoximes and divinyl ketone. Remarkable rate enhancement and control of cycloaddition regiochemistry by hafnium(iv) chloride". Chemical Communications (20): 2035–2036. doi:10.1039/b005389i.
- ↑ Choi, J. H.; Mao, Y.; Chang, J. P. (2011). "Development of hafnium based high-k materials—A review". Materials Science and Engineering: R: Reports 72 (6): 97. doi:10.1016/j.mser.2010.12.001.
- ↑ John_Robertson_(physicist) (2006). "High dielectric constant gate oxides for metal oxide Si transistors". Reports on Progress in Physics 69 (2): 327–396. doi:10.1088/0034-4885/69/2/R02. Bibcode: 2006RPPh...69..327R.