இருகந்தக இருகுளோரைடு
இருகந்தக இருகுளோரைடு (Disulfur dichloride) என்பது S2Cl2 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட, கந்தகம் மற்றும் குளோரின் சேர்ந்து உருவாகும் ஒரு கனிம வேதியியல் சேர்மமாகும்[4][5][6] [7]
| |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
டைசல்பர் டைகுளோரைடு
| |||
| முறையான ஐயூபிஏசி பெயர்
இருகுளோரோயிருசல்ஃபேன் | |||
| வேறு பெயர்கள்
பிசு[குளொரிடோகந்தகம்](S–S)
இருபடி சல்ஃபெனிக் குளோரைடு | |||
| இனங்காட்டிகள் | |||
| 10025-67-9 85408-26-0 (சமபியூட்டனேட்டு) | |||
| ChemSpider | 23192 19158348 (சமபியூட்டனேட்டு) | ||
| EC number | 233-036-2 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| ம.பா.த | கந்தக+ஒருகுளோரைடு | ||
| பப்கெம் | 24807 | ||
| வே.ந.வி.ப எண் | WS4300000 | ||
| |||
| UN number | 3390 | ||
| பண்புகள் | |||
| S2Cl2 | |||
| வாய்ப்பாட்டு எடை | 135.04 கி/மோல் | ||
| தோற்றம் | மெல்லிய பிசின் நிறம் தொடங்கி மஞ்சள் சிவப்பு நிறம் வரை, எண்ணெய் வகை திரவம்[1] | ||
| மணம் | காரநெடி, குமட்டல் நெடி,எரிச்சலூட்டும் நெடி[1] | ||
| அடர்த்தி | 1.688 கி/செ.மீ3 | ||
| உருகுநிலை | −80 °C (−112 °F; 193 K) | ||
| கொதிநிலை | 137.1 °C (278.8 °F; 410.2 K) | ||
| சிதைவடையும், HCl இழப்பு ஏற்படும் | |||
| கரைதிறன் | soluble in எத்தனால், பென்சீன், ஈதர், குளோரோஃபார்ம், கார்பன் நாற்குளோரைடு ஆகியனவற்றில் கரையும் [2] | ||
| ஆவியமுக்கம் | 7 மி.மீ.பாதரசம் (20 °செல்சியசு | ||
| ஒளிவிலகல் சுட்டெண் (nD) | 1.658 | ||
| கட்டமைப்பு | |||
| ஒருங்கிணைவு வடிவியல் |
C2, மறைவுறா | ||
| இருமுனைத் திருப்புமை (Dipole moment) | 1.60 D [2] | ||
| தீங்குகள் | |||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0958 | ||
| ஈயூ வகைப்பாடு | நச்சு (T) தீங்கானது (Xn) அரிக்கும் (C) சுற்ருச்சூழலுக்கு கேடு விளைவிக்கும் (N) | ||
| R-சொற்றொடர்கள் | R14, R20, R25, R29, R35, R50 | ||
| S-சொற்றொடர்கள் | (S1/2), S26, S36/37/39, S45, S61 | ||
| தீப்பற்றும் வெப்பநிலை | 118.5 °C (245.3 °F; 391.6 K) | ||
Autoignition
temperature |
234 °C (453 °F; 507 K) | ||
| Lethal dose or concentration (LD, LC): | |||
LCLo (Lowest published)
|
150 மில்லியனுக்கு ஒரு பங்கு (சுண்டெலி, 1 நிமிடம்)[3] | ||
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |||
அனுமதிக்கத்தக்க வரம்பு
|
TWA 1 மில்லியனுக்கு ஒரு பங்கு (6 மி.கி/மீ3)[1] | ||
பரிந்துரைக்கப்பட்ட வரம்பு
|
C 1 மில்லியனுக்கு ஒரு பங்கு (6 மி.கி/மி3)[1] | ||
உடனடி அபாயம்
|
5 மில்லியனுக்கு ஒரு பங்கு[1] | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
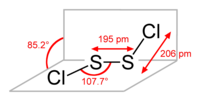
தனிமங்களின் எளிய முழுவெண் விகிதத்தின் அடிப்படையில் கந்தக ஒரு குளோரைடு என்ற பெயராலும் இருகந்தக இருகுளோரைடு அழைக்கப்படுகிறது. S2Cl2 என்ற கட்டமைப்பில் Cl-S-S-Cl என்ற வாய்ப்பாடு உட்கிடையாக அமைந்துள்ளது. இவ்வமைப்பில் Cla-S-S மற்றும் S-S-Clb தளங்களின் கோணமதிப்பு 90° ஆகும். மறைவுறா வடிவமான இவ்வமைப்பானது H2O2 இன் அமைப்புடன் பண்பொத்த அமைப்பாக உள்ளது. இருகந்தக இருகுளோரைடின் மற்றொரு மாறுபட்ட மாற்றியன் S=SCl2 ஆகும். இருகந்தக இருகுளோரைடை புற ஊதாக் கதிர்வீச்சுக்கு உட்படுத்தினால் நிலையற்ற மாற்றம் மூலமாக இம்மாற்றியன் உருவாகிறது.
இரசாயன ஆயுதங்கள் மாநாடு தடைசெய்த முன்னோடி வேதிச்சேர்மங்களின் பட்டியலில், இந்த வேதிச்சேர்மம் அட்டவணை 3 பகுதி ஆ- வில் பட்டியலிடப்பட்டுள்ளது. இப்பட்டியலில் இடம்பெற்றுள்ள வேதிப்பொருள்களை உற்பத்தி செய்ய அல்லது செயல்முறைகளை தொடர அல்லது உபயோகப்படுத்த கட்டுப்பாடுகள் விதிக்கப்பட்டுள்ளன. இரசாயன ஆயுதங்கள் தடை அமைப்பு நிறுவனம் திட்டமிட்ட வழிமுறைகள் மற்றும் ஆய்வு அறிக்கைகள் மூலமாக இக்கட்டுப்பாடுகளை விதிக்கிறது.
தயாரிப்பு முறைகள்
தொகுதூய்மையான இருகந்தக இருகுளோரைடு மஞ்சள் நிறத்தில் ஒரு திரவமாகவும், காற்றில் உள்ள நீருடன் வினைபுரிவதால் புகையும் தன்மையுடனும் காணப்படுகிறது.
- 2 S2Cl2 + 2 H2O → SO2 + 4 HCl + 3/8 S8
தனிமநிலை கந்தகத்தை பகுதியாக குளோரினேற்றம் செய்வதன் மூலமாக இருகந்தக இருகுளோரைடு தயாரிக்க முடியும். இவ்வினை அறைவெப்பநிலையில் சாதாரண வீதத்தில் நிகழ்கிறது.
தனிமநிலை கந்தகம் உள்ள குடுவைக்குள் குளோரின் வாயுவைச் செலுத்துவதன் மூலம் ஆய்வகமுறையில் இருகந்தக இருகுளோரைடு தயாரிக்கப்படுகிறது. தங்கமஞ்சள் நிறத்துடன் ஒரு திரவமாக இச்சேர்மம் உருவாகிறது.[8]
- S8 + 4 Cl2 → 4 S2Cl2 ΔH = −58.2 கியூ/மோல்
குளோரின் அதிகமாகச் செலுத்தப்பட்டால் கந்தக இருகுளோரைடு உருவாகிறது. இதனால் திரவம் வெளிர் மஞ்சளாகவும் அதிகமான ஆரஞ்சு சிவப்பாகவும் மாறுகிறது.
- S2Cl2 + Cl2 ↔ 2 SCl2 ΔH = −40.6 கியூ/மோல்
இவ்வினை ஒரு மீள்வினையாகும். சிறிது நேரத்தில் SCl2 குளோரின் வாயுவை வெளிவிடுகிறது. இதனால் இருகந்தக இருகுளோரைடு மீட்சியடைகிறது. அதிக அளவிலான கந்தகத்தை இருகந்தக இருகுளோரைடு கரைக்கும் வல்லமை மிக்கது ஆகும். இதனால் பல்சல்ஃபேன்கள் உருவாகின்றன.
- S2Cl2 + n S → S2+nCl2
மஞ்சள் ஆரஞ்சு திரவ இருகந்தக இருகுளோரைடை தனிமநிலை கந்தகம் சேர்த்து காய்ச்சி வடித்தால் தூய்மையான இருகந்தக இருகுளோரைடைப் பெற முடியும்.
தயோபாசுசீன் தயாரிப்பு போலவே, கார்பன் டை சல்பைடை குளோரினேற்றம் செய்தும் இச்சேர்மத்தைத் தயாரிக்க முடியும்.
வினைகள்
தொகுS2Cl2 சேர்மத்தை நீராற்பகுப்பு செய்தால் கந்தக டை ஆக்சைடாகவும் தனிமநிலை கந்தகமாகவும் பிரிகிறது. ஐதரசன் சல்பைடுடன் சேர்த்து சூடாக்கினால் பல்சல்ஃபேன்கள் உருவாகின்றன. இதற்கான சமன்பாடு,
- 2 H2S + S2Cl2 → H2S4 + 2 HCl
அமோனியாவுடன் இருகந்தக இருகுளோரைடு வினைபுரிந்து எழுகந்தகயிமைடு (S7NH) மற்றும் தொடர்புடைய S-N வளையங்கள் S8-x(NH)x (x = 2, 3)
பயன்கள்
தொகுசேர்மத்தில் கார்பன் – கந்தகம் பிணைப்பை அறிமுகப்படுத்த S2Cl2 பயன்படுத்தப்படுகிறது. அலுமினியம் குளோரைடு முன்னிலையில் இருகந்தக இருகுளோரைடு பென்சீனுடன் வினைபுரிந்து இருபீனைல்சல்பைடு உண்டாகிறது.
- S2Cl2 + 2 C6H6 → (C6H5)2S + 2 HCl + 1/8 S8
சோடியம் ஐதராக்சைடு முன்னிலையில் அனிலீன்கள் இருகந்தக இருகுளோரைடு டன் எர்சு வினை வழியாக வினைபுரிந்து ஆர்தோ-அமினோதயோபீனோலேட்டுகள் உருவாகின்றன. தயோ இண்டிகோ சாயங்கள் தயாரிப்பிற்கு இவை முன்னோடி சேர்மங்களாகும். இலெவின்சிடெய்ன் செயல்முறையில், 60 பாகை செல்சியசு வெப்பநிலையில் எத்திலினுடன் வினைபுரிந்து இது கடுகு வளிமம் தயாரிப்பதற்கும் பயன்படுத்தப்படுகிறது.
- S2Cl2 + 2 C2H4 → (ClC2H4)2S + 1/8 S8
- S2Cl2 + 2 C2H4 → (ClC2H4)2S + 1/8 S8
கந்தகச் சாயங்கள், பூச்சிக்கொல்லிகள், செயற்கை ரப்பர்கள் உற்பத்தி முதலியன பிற பயன்பாடுகளாகும். மேலும், இரப்பரை கடினமாக்குதல், மென்பொருட்களை கடினமாக்கல், காய்கறி எண்ணெய்களை பலபடியாக்கும் வினையூக்கி எனப் பல்வேறு வகையன பயன்பாடுகளைப் பெற்றுள்ளது.
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 1.2 1.3 1.4 "NIOSH Pocket Guide to Chemical Hazards #0578". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 2.0 2.1 Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, பன்னாட்டுத் தரப்புத்தக எண் 0-07-049439-8
- ↑ "Sulfur monochloride". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
- ↑ Hartman, W. W.; Smith, L. A.; Dickey, J. B. (1934). "Diphenylsulfide". Organic Syntheses 14: 36. http://www.orgsyn.org/demo.aspx?prep=cv2p0242.; Collective Volume, vol. 2, p. 242
- ↑ R. J. Cremlyn An Introduction to Organosulfur Chemistry John Wiley and Sons: Chichester (1996). பன்னாட்டுத் தரப்புத்தக எண் 0-471-95512-4
- ↑ Garcia-Valverde M., Torroba T. (2006). "Heterocyclic chemistry of sulfur chlorides - Fast ways to complex heterocycles". European Journal of Organic Chemistry 4 (4): 849–861. doi:10.1002/ejoc.200500786.
- ↑ F. Fehér "Dichlorodisulfane" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 371.

