ஆர்சனிக் முக்குளோரைடு
ஆர்சனிக் முக்குளோரைடு (Arsenic trichloride) என்பது AsCl3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு வேதிச் சேர்மம் ஆகும். இது ஆர்சனசு குளோரைடு அல்லது ஆர்சனிக்கின் வெண்ணெய் என்றும் அழைக்கப்படுகிறது. நச்சுத்தன்மையுள்ள இந்த எண்ணெய் நிறமற்றது. தூய்மைப்படுத்தப்படாத மாதிரிகள் சில மஞ்சள் நிறத்தில் காணப்படலாம். கரிம ஆர்சனிக் சேர்மங்களைத் தயாரிக்கும்போது இது இடைநிலையாகத் தோன்றுகிறது.[2]
| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
ஆர்சனிக்(III) குளோரைடு, ஆர்சனசு முக்குளோரைடு, ஆர்சனிக் வெண்ணெய், டெ வாலகின்சு கரைசல்
| |
| இனங்காட்டிகள் | |
| 7784-34-1 | |
| ChemSpider | 22974 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24570 |
| வே.ந.வி.ப எண் | CG1750000 |
| |
| பண்புகள் | |
| AsCl3 | |
| வாய்ப்பாட்டு எடை | 181.28 கி/மோல் |
| தோற்றம் | நிறமற்ற நீர்மம் |
| அடர்த்தி | 2.163 கி/செ,மீ3, திரவம் |
| உருகுநிலை | −16.2 °C (2.8 °F; 256.9 K) |
| கொதிநிலை | 130.2 °C (266.4 °F; 403.3 K) |
| சிதைவடையும் | |
| கரைதிறன் | ஆல்ககால், ஈதர், HCl, HBr ஆகியவற்றில் கரையும் |
| ஒளிவிலகல் சுட்டெண் (nD) | 1.6006 |
| பிசுக்குமை | 9.77 x 10−6 Pa s |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | அதிக நச்சு (T+) சூழலுக்கு அபாயமானது (N) |
| R-சொற்றொடர்கள் | R23/25, R50/53 |
| S-சொற்றொடர்கள் | (S1/2), S20/21, S28, S45, S60, S61 |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
48 மி.கி/கி.கி |
LCLo (Lowest published)
|
100 மி.கி/மீ3 (பூனை, 1 மணி) 200 மி.கி/மீ 3 (பூனை, 20 நிமிடங்கள்) 338 ppm (எலி, 10 நிமிடங்கள்)[1] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | ஆர்சனிக் மூவாக்சைடு |
| ஏனைய நேர் மின்அயனிகள் | ஆன்டிமணி முக்குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
அமைப்பு
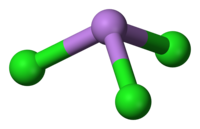
தொகுபட்டைக் கூம்பு மூலக்கூறு வடிவத்தில் C3v சீரொழுங்குடன் AsCl3 அமைந்துள்ளது. As-Cl பிணைப்பு நீளம் 2.161 Å ஆகவும் Cl-As-Cl இன் பிணைப்புக் கோணம் 98° 25'±30.[3][4] ஆகவும் உள்ளது. நிறமாலையியல் ஆய்வில் AsCl3 நான்கு சாதாரண வகை அதிர்வுகளை வெளிப்படுத்துகிறது. அவை: ν1(A1) 416, ν2(A1) 192, ν3 393, மற்றும் ν4(E) 152 செ.மீ−1 ஆர்சனிக் முக்குளோரைடில் உள்ள சகப்பிணைப்புகள் இதன் தாழ் உருகுநிலையை விவரிக்கின்றன[5].
தயாரிப்பு
தொகுஆர்சனிக்(III) ஆக்சைடுடன் ஐதரசன் குளோரைடைச் சேர்த்து வினைப்படுத்தி காய்ச்சி வடித்தல் மூலம் இந்த நிறமற்ற நீர்மம் தயாரிக்கப்படுகிறது.
- As2O3 + 6 HCl → 2 AsCl3 + 3 H2O
தனிமநிலை ஆர்சனிக்கை 80 – 85 0 செல்சியசு வெப்பநிலையில் குளோரினேற்றம் செய்வதன் மூலமாகவும் ஆர்சனிக் முக்குளோரைடத் தயாரிக்கலாம்[2]
- 2 As + 3 Cl2 → 2 AsCl3
ஆர்சனிக் ஆக்சைடுடன் கந்தக ஒருகுளோரைடை வினைபுரியச் செய்தும் ஆர்சனிக் முக்குளோரைடைத் தயாரிக்கலாம். இதற்கு எளிமையான கருவிகளும் சிறப்பான செயல்பாடும் முக்கியமானவையாகும்:[6]
- 2 As2O3 + 6 S2Cl2 → 4 AsCl3 + 3 SO2 + 9 S
வினைகள்
தொகுதண்ணீருடன் சேர்ந்து ஆர்சனிக் முக்குளோரைடு நீராற்பகுப்பு அடைந்து ஆர்சனசமிலத்தையும் ஐதரோ குளோரிக் அமிலத்தையும் கொடுக்கிறது.
- AsCl3 + 3 H2O → As(OH)3 + 3 HCl
பாசுபரசு முக்குளோரைடைக் காட்டிலும் குறைவாக ஈரப்பத்தில் பாதிக்கப்பட்டாலும் இது ஈரமான காற்றில் புகையக்கூடியதாக இருக்கிறது[7].
ஆர்சனிக் மூவாக்சைடுடன் இதைச் சேர்க்கும் போது ஆர்சனிக் முக்குளோரைடு மறுபகிர்வு அடைந்து கனிம பலபடியாக ( AsOCl) நிலைமாறுகிறது. குளோரைடு மூலங்களுடன் வினைபுரியும் போது இது, [AsCl4]− எதிர் அயனிகள் கொண்ட உப்புகளை உருவாக்குகிறது. பொட்டாசியம் புரோமைடு மற்றும் பொட்டாசியம் அயோடைடு ஆகிய சேர்மங்களுடன் வினைபுரிந்து முறையே ஆர்சனிக் முப்புரோமைடு மற்றும் ஆர்சனிக் மூவயோடைடு ஆகிய சேர்மங்களைத் தருகிறது.
கரிம ஆர்சனிக் வேதியியலில் ஆர்சனிக் முக்குளோரைடு முக்கியப் பங்கு வகிக்கிறது. உதாரணமாக முப்பீனைல் ஆர்சின் இதைக் கொண்டு தயாரிக்கப்படுகிறது:[8].
- AsCl3 + 6 Na + 3 C6H5Cl → As(C6H5)3 + 6 NaCl
பாதுகாப்பு
தொகுArsenic compounds are highly toxic, and AsCl3 especially so because of its volatility and solubility.
மேற்கோள்கள்
தொகு- ↑ "Arsenic (inorganic compounds, as As)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 2.0 2.1 Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf "Arsenic and Arsenic Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, VCH-Wiley, 2008, Weinheim.எஆசு:10.1002/14356007.a03_113.pub2
- ↑ P. Kisliuk; C. H. Townes. "The Microwave Spectra and Molecular Structure of Phosphorus and Arsenic Trichloride". J. Chem. Physics 1950, 18.
- ↑ Jean Galy; Renee Enjalbertl Pierre Lecante; Andrzej Burian "AsCl3: From the crystalline to the liquid state. XRD (176< T (K) < 250) and WAXS (295K) studies" Inorg. Chem 2002, volume 41, pp. 693–698.எஆசு:10.1021/ic0102788
- ↑ Klapoetke, Thomas M. "The vibrational spectrum of arsenic trichloride" Main Group Metal Chemistry 1997, volume 20, pp. 81–83.
- ↑ R. C. Smith, "Manufacture of Arsenic trichloride" The Journal of Industrial and Engineering Chemistry 1919, volume 11, pp. 109–110. எஆசு:10.1021/ie50110a009
- ↑ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
- ↑ Shriner, R. L.; Wolf, C. N. (1963). "Tetraphenylarsonium Chloride Hydrochloride". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv4p0910.; Collective Volume, vol. 4, p. 910. Describes the preparation of As(C6H5)3.