சமாரியம்(III) குளோரைடு
சமாரியம்(III) குளோரைடு (Samarium(III) chloride) என்பது SmCl3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். இச்சேர்மம் சமாரியம் முக்குளோரைடு என்றும் அழைக்கப்படுகிறது. சமாரியம் மற்றும் குளோரைடு அயனிகள் சேர்ந்து உருவாகும் இச்சேர்மம் வெளிர் மஞ்சள் நிறத்தில் காணப்படுகிறது. விரைவாகத் தண்ணீரை ஈர்த்துக் கொண்டு அறுநீரேற்று வடிவ SmCl3.6H2O சேர்மமாக மாறுகிறது.[1] சிலநடைமுறைப் பயன்பாடுகளைக் கொண்டிருப்பினும், சமாரியம்(III) குளோரைடு பெரும்பாலும் புதிய சமாரியம் சேர்மங்களைக் கண்டறியும் முனைப்போடு ஆய்வகங்களில் பயன்படுத்தப்பட்டுவருகிறது.

| |
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
சமாரியம்(III) குளோரைடு
| |
| இனங்காட்டிகள் | |
| 10361-82-7 (நீரிலி) 13465-55-9 (அறுநீரேற்று) | |
| ChemSpider | 55428 |
| யேமல் -3D படிமங்கள் | Image |
| |
| UNII | 5J4QGH7J16 |
| பண்புகள் | |
| SmCl3 | |
| வாய்ப்பாட்டு எடை | 256.76 கி/மோல் (நீரிலி) 364.80 கி/மோல் (அறுநீரேற்று) |
| தோற்றம் | வெளிர் மஞ்சள் நிறத் திண்மம் (நீரிலி)
பாலேடு நிறத் திண்மம் (அறுநீரேற்று) |
| அடர்த்தி | 4.46 கி/செ.மீ3 (நீரிலி)
2.383 கி/செ.மீ3 (அறுநீரேற்று) |
| உருகுநிலை | 682 °C (1,260 °F; 955 K) |
| கொதிநிலை | சிதைவடையும் |
| 92.4 கி/100 மி.லி (10 °செ) | |
| கட்டமைப்பு | |
| படிக அமைப்பு | அறுகோணம், hP8 |
| புறவெளித் தொகுதி | P63/எம் எண். 176 |
| ஒருங்கிணைவு வடிவியல் |
மூவுச்சி முக்கோண முப்பட்டகம் (ஒன்பது ஒருங்கிணைவுகள்) |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | உறுத்தும் |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | சமாரியம்(III) ஆக்சைடு |
| ஏனைய நேர் மின்அயனிகள் | புரோமெத்தியம்(III) குளோரைடு, யூரோப்பியம்(III) குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
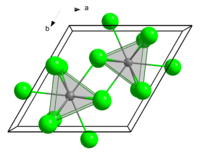
அமைப்பு
தொகுதொடர்புடைய மற்ற இலந்தனைடு மற்றும் ஆக்டினைடு குளோரைடுகள் போலவே சமாரியம்(III) குளோரைடு UCl3 நோக்குருவில் படிகமாகிறது. Sm3+ மையங்கள் ஒன்பது ஒருங்கிணைவுகள் கொண்டு முக்கோண முப்பட்டகத் தளங்களை ஆக்கிரமித்துள்ளன. மேலும். மூன்று சதுர முகங்களில் கூடுதலாக குளோரைடு ஈந்தணைவிகள் இவற்றில் நிரம்பியுள்ளன.
தயாரிப்பும் வினைகளும்
தொகுஅமோனியம் குளோரைடில் தொடங்கும் வழிமுறையில் சமாரியம்(III) குளோரைடு தயாரிக்கப்படுகிறது. 230 பாகை செல்சியசு வெப்பநிலையில் அமோனியம் குளோரைடுடன் சமாரியம் ஆக்சைடு சேர்க்கப்பட்டு (NH4)2[SmCl5] என்ற சேர்மத்தைத் தயாரிக்கும் தொகுப்பு வினையுடன் இவ்வழிமுறை தொடங்குகிறது.:[2]
- 10 NH4Cl + Sm2O3 → 2 (NH4)2[SmCl5] + 6 NH3 + 3 H2O
இந்த ஐங்குளோரைடு மீண்டும் 350-400 ° செல்சியசு வெப்பநிலைக்குச் சூடுபடுத்தப்பட்டால் அமோனியம் குளோரைடு வெளியேற்றப்பட்டு வீழ்படிவாக நீரிலி வடிவ சமாரியம் முக்குளோரைடு கிடைக்கிறது.
- (NH4)2[SmCl5] → 2 NH4Cl + SmCl3
சமாரியம் உலோகத்துடன் ஐதரசன் குளோரைடு சேர்த்தும் இதைத் தயாரிக்க முடியும்.[3][4]
- 2 Sm + 6 HCl → 2 SmCl3 + 3 H2
சமாரியம் உலோகம் அல்லது சமாரியம் கார்பனேட்டை ஐதரோ குளோரிக் அமிலத்தில் கரைத்து சமாரியம்(III) குளோரைடின் நீர்க்கரைசலைத் தயாரிக்கலாம்.
சமாரியம்(III) குளோரைடு ஒரு வலிமையான இலூயிக் அமிலமாகும். சமாரியம்(III) குளோரைடின் நீர்க்கரைசலைப் பயன்படுத்தி சமாரியம் முப்புளோரைடைத் தயாரிக்க முடியும்.
- SmCl3 + 3 KF → SmF3 + 3 KCl
பயன்கள்
தொகுசமாரியம் உலோகத்தைத் தயாரிப்பதற்கு சமாரியம்(III) குளோரைடு பயன்படுகிறது. சமாரியம் உலோகம் பல்வேறு வகைகளில் பயன்படுகிறது. குறிப்பாக காந்தங்கள் தயாரிப்பில் இது பெரும்பங்கு வகிக்கிறது. நீரிலி வடிவ சமாரியம் முக்குளோரைடு, சோடியம் குளோரைடு அல்லது கால்சியம் குளோரைடுடன் சேர்க்கப்பட்டு நல்லுருகுபுள்ளிக் கலவை தயாரிக்கப்படுகிறது. உருகிய இவ்வுப்புக் கரைசலை மின்னாற்பகுப்பு செய்து தூய சமாரியம் உலோகம் தயாரிக்கப்படுகிறது.[5]
ஆய்வகப் பயன்கள்
தொகுநீரிலி வடிவ சமாரியம் முக்குளோரைடு, கரிம உலோகச் சேர்மங்கள் தயாரிக்கவும் பல்வேறு சமாரிய உப்புகள் தயாரிப்பில் சமாரியம் முக்குளோரைடும் ஆய்வகங்களில் பயன்படுகின்றன.[6]
மேற்கோள்கள்
தொகு- ↑ F. T. Edelmann, P. Poremba (1997). W. A. Herrmann (ed.). Synthetic Methods of Organometallic and Inorganic Chemistry. Vol. 6. Stuttgart: Georg Thieme Verlag.
- ↑ Meyer, G. (1989). "The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides-The Example of YCl3". Inorganic Syntheses 25: 146–150. doi:10.1002/9780470132562.ch35. பன்னாட்டுத் தரப்புத்தக எண்:978-0-470-13256-2.
- ↑ L. F. Druding, J. D. Corbett (1961). J. Am. Chem. Soc. 83 (11): 2462. doi:10.1021/ja01472a010.
- ↑ J. D. Corbett (1973). Rev. Chim. Minerale 10: 239.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. பன்னாட்டுத் தரப்புத்தக எண் 0-08-022057-6.
{{cite book}}: Cite has empty unknown parameter:|1=(help) - ↑ G. A. Molander, E. D. Dowdy (1999). Shu Kobayashi (ed.). Lanthanides: Chemistry and Use in Organic Synthesis. Berlin: Springer-Verlag. pp. 119–154. பன்னாட்டுத் தரப்புத்தக எண் 3-540-64526-8.