இலந்தனம்(III) குளோரைடு
இலந்தனம் குளோரைடு (Lanthanum chloride) என்பது LaCl3.என்ற மூலக்கூற்று வாய்ப்பாடு கொண்டுள்ள ஒரு கனிம வேதியியல் சேர்மாகும். இச்சேர்மம் பொதுவான ஒரு உப்பாகக் காணப்பட்டாலும் பிரதானமாக ஆய்வுக்காகவே பயன்படுத்தப்படுகிறது. வெண்மை நிறத்தில் இருக்கும் இலந்தனம் குளோரைடு தண்ணீர் மற்றும் ஆல்ககாலில் நன்றாகக் கரைகிறது.
| |||
| பெயர்கள் | |||
|---|---|---|---|
| வேறு பெயர்கள்
இல்ந்தனம் முக்குளோரைடு
| |||
| இனங்காட்டிகள் | |||
| 10099-58-8 20211-76-1 (எழுநீரேற்று) | |||
| ChemSpider | 58275 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 64735 | ||
| |||
| பண்புகள் | |||
| LaCl3 | |||
| வாய்ப்பாட்டு எடை | 245.26 கி/மோல் (நீரிலி) 353.36 கி/மோல் (அறுநீரேற்று) 371.37 கி/மோல் (எழுநீரேற்று) | ||
| தோற்றம் | வெண்மையான துகள் நீருறிஞ்சும் | ||
| அடர்த்தி | 3.84 கி/செ.மீ3 | ||
| உருகுநிலை | 858 °C (1,576 °F; 1,131 K) (நீரிலி)[1] | ||
| கொதிநிலை | 1,000 °C (1,830 °F; 1,270 K) (நீரிலி) | ||
| நன்றாகக் கரையும் | |||
| கரைதிறன் | எத்தனாலில் கரையும் (எழுநீரேற்று) | ||
| கட்டமைப்பு | |||
| படிக அமைப்பு | அறுகோணம் (UCl3 வகை), hP8 | ||
| புறவெளித் தொகுதி | P63/m, No. 176 | ||
| ஒருங்கிணைவு வடிவியல் |
முச்சதுர மும்முகப் பட்டகம்,(ஒன்பது ஒருங்கிணைப்புகள்) | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | இலந்தனம் ஆக்சைடு | ||
| ஏனைய நேர் மின்அயனிகள் | சீரியம்(III) குளோரைடு | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
அமைப்பு
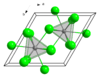
தொகுஇம்முக்குளோரைடில் La3+ மையங்கள் 9- ஒருங்கிணைப்புகளைக் கொண்டுள்ளன. யுரேனியம் முக்குளோரைடை ஒத்த மூலக்கூறு அமைப்பை லாந்தனம் குளோரைடும் பெற்றுள்ளது.
தயாரிப்பு மற்றும் வினைகள்
தொகுதனிமங்கள் இணைந்த ஒரு குழுவாக இலந்தனம் குளோரைடு உருவாகிறது. ஆனால் பொதுவாக இலந்தனம்(III) ஆக்சைடு மற்றும் அமோனியம் குளோரைடு இரண்டும் 200 முதல் 250 0 செல்சியசு வெப்பநிலைக்குச் சூடு படுத்தும் போது இலந்தனம்(III) குளோரைடு உருவாகிறது.:[2]
- La2O3 + 6 NH4Cl → 2 LaCl3 + 6 NH3 + 2 H2O
மற்ற மூவாலைடுகளை இம்முக்குளோரைடில் இருந்து பரிமாற்ற வினையின் மூலம் தயாரித்துக் கொள்ள முடியும். பொட்டாசியத்துடன் லாந்தனம்(III) குளோரைடை ஒடுக்குதல் வினைக்கு உட்படுத்துதல் மூலம் தனிமநிலை லாந்தனத்தைப் பெறமுடியும்.
பயன்கள்
தொகுஇலந்தனம் குளோரைடின் பயன்பாடுகள் மிகுதியாக அறியப்படவில்லை. கரைசல்களில் இருந்து பாசுபேட்டை வீழ்படிவாக்க உதவுதல் மட்டுமே இதனுடைய ஒரே சாத்தியமான பயன்பாடு ஆகும். நீச்சல் குளங்களில் பாசிகள் வளர்ச்சியைத் தடுக்கவும் வடிகட்ட உதவும் பொருளாகவும் மற்றும் பயனுள்ள வேதிப்பாளங்களாகவும் இது பயன்படுகிறது. உயிர்வேதியியல் ஆய்வுகளில் ஈரிணைதிறன் நேர்மின் அயனிகளின் செயல்பாட்டைக் குறிப்பாக கால்சியம் தடங்களைக் கட்டுப்படுத்துகிறது. சீரியம் உலோகத்துடன் கலப்பிட்டு இதையொரு மினுமினுக்கும் பொருளாகப் பயன்படுத்த முடியும்.
கரிமத் தொகுப்பு வினைகளில் லாந்தனம் குளோரைடு ஒரு மிதமான இலூயிக் அமிலமாகச் செயல்பட்டு ஆல்டிகைடுகளை அசிட்டால்களாக மாற்றவும் உதவுகிறது.
ஐதரோகுளோரிக் அமிலமும் ஆக்சிசனும்[3] பங்கேற்று மீத்தேனை குளோரோ மீத்தேனாக்கும் உயரழுத்த ஆக்கிசனேறும் குளோரினேற்ற வினையில் ஒரு வினையூக்கியாக இச்சேர்மம் பயன்படுகிறது.
கனிமச் சேர்மங்களில் பயன்படும் மிகச்சிறிய உணர்த்துக் கருவியாக, காமா கதிர்களை கண்டு உணர்த்தும் பணிக்கு இது பயன்படுகிறது.
மேற்கோள்கள்
தொகு- ↑ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. பன்னாட்டுத் தரப்புத்தக எண் 0-8493-0487-3.
- ↑ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY.
- ↑ Podkolzin SG, Stangland EE, Jones ME, Peringer E, Lercher JA (2007). "Methyl chloride production from methane over lanthanum-based catalysts". J. Am. Chem. Soc. 129 (9): 2569–76. doi:10.1021/ja066913w. பப்மெட்:17295483.