பாமிக் அமிலம்
பார்மிக் அமிலம் (Formic acid) என்பது ஒரு வகை கார்பாக்சிலிக் அமிலமாகும். முறையான பெயரிடல் முறையில் இது மெதனாயிக் அமிலம் என்று அழைக்கப்படுகிறது; இதன் வேதி வாய்பாடு HCOOH அல்லது CH2O2. எறும்புகளில், குறிப்பாக, எறும்புக்கடியில் இந்த அமிலம் உள்ளது; இது தவிர, ஹைமெனாப்டெரா என்ற வரிசையில் உள்ள தேனீக்கள், எறும்புகள் உள்ளிட்ட பல பூச்சிகளின் கடியில் இது உள்ளது[5].
| |||

| |||
| பெயர்கள் | |||
|---|---|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
Formic acid[1] | |||
| முறையான ஐயூபிஏசி பெயர்
Methanoic acid[1] | |||
| வேறு பெயர்கள்
Carbonous acid; Formylic acid; Hydrogen carboxylic acid; Hydroxy(oxo)methane; Metacarbonoic acid; Oxocarbinic acid; Oxomethanol
| |||
| இனங்காட்டிகள் | |||
| 64-18-6 | |||
| ChEBI | CHEBI:30751 | ||
| ChEMBL | ChEMBL116736 | ||
| ChemSpider | 278 | ||
| DrugBank | DB01942 | ||
| EC number | 200-579-1 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| KEGG | C00058 | ||
| பப்கெம் | 284 | ||
| வே.ந.வி.ப எண் | LQ4900000 | ||
| |||
| UNII | 0YIW783RG1 | ||
| பண்புகள் | |||
| CH2O2 | |||
| வாய்ப்பாட்டு எடை | 46.03 g·mol−1 | ||
| தோற்றம் | Colorless fuming liquid | ||
| மணம் | Pungent, penetrating | ||
| அடர்த்தி | 1.220 g/mL | ||
| உருகுநிலை | 8.4 °C (47.1 °F; 281.5 K) | ||
| கொதிநிலை | 100.8 °C (213.4 °F; 373.9 K) | ||
| Miscible | |||
| கரைதிறன் | Miscible with ஈதர், அசிட்டோன், ஈத்தைல் அசிட்டேட்டு, கிளிசரால், மெத்தனால், எத்தனால் Partially soluble in பென்சீன், தொலுயீன், xylenes | ||
| மட. P | −0.54 | ||
| ஆவியமுக்கம் | 35 mmHg (20 °C)[2] | ||
| காடித்தன்மை எண் (pKa) | 3.77[3] | ||
| -19.90·10−6 cm3/mol | |||
| ஒளிவிலகல் சுட்டெண் (nD) | 1.3714 (20 °C) | ||
| பிசுக்குமை | 1.57 cP at 268 °C | ||
| கட்டமைப்பு | |||
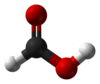
| மூலக்கூறு வடிவம் | |||
| இருமுனைத் திருப்புமை (Dipole moment) | 1.41 D (gas) | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH |
−425.0 kJ/mol | ||
| Std enthalpy of combustion ΔcH |
−254.6 kJ/mol | ||
| நியம மோலார் எந்திரோப்பி S |
131.8 J/mol K | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | Corrosive; irritant; sensitizer | ||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | JT Baker | ||
| R-சொற்றொடர்கள் | R10 R35 | ||
| S-சொற்றொடர்கள் | (S1/2) S23 S26 S45 | ||
| தீப்பற்றும் வெப்பநிலை | 69 °C (156 °F; 342 K) | ||
Autoignition
temperature |
601 °C (1,114 °F; 874 K) | ||
| வெடிபொருள் வரம்புகள் | 14 – 34%[சான்று தேவை] 18% – 57% (90% solution)[2] | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (Median dose)
|
700 mg/kg (mouse, oral), 1100 mg/kg (rat, oral), 4000 mg/kg (dog, oral)[4] | ||
LC50 (Median concentration)
|
7853 ppm (rat, 15 min) 3246 ppm (mouse, 15 min)[4] | ||
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |||
அனுமதிக்கத்தக்க வரம்பு
|
TWA 5 ppm (9 mg/m3)[2] | ||
பரிந்துரைக்கப்பட்ட வரம்பு
|
TWA 5 ppm (9 mg/m3)[2] | ||
உடனடி அபாயம்
|
30 ppm[2] | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
சொற்தோற்றம்
தொகு'எறும்புகளிலிருந்து' என்ற பொருள் வரும் ஃபார்மிகா என்ற இலத்தீன் சொல்லிலிருந்து 1791ல் உருவாக்கப்பட்டது பார்மிக் என்ற சொல்[6].
p to பார்மிக் அமிலம் ஒரு நிறமற்ற திரவமாகும், இது ஒரு வெப்பமான, அறை வெப்பநிலையில் [5] ஊடுருவிச் செல்கிறது. இது நீர் மற்றும் மிகவும் துருவ கரிம கரைப்பான்களுடன் பிரிக்கப்பட்டு ஹைட்ரோகார்பன்களில் ஓரளவு கரையக்கூடியதாக இருக்கிறது. ஹைட்ரோகார்பன்களில் மற்றும் நீராவி கட்டத்தில், அது தனி மூலக்கூறுகளை விட ஹைட்ரஜன்-பிணைக்கப்பட்ட டைமர்களைக் கொண்டுள்ளது. [6] [7] ஹைட்ரஜன்-பிணைப்பு, வாயு ஃபார்மிக் அமிலம் ஆகியவற்றின் போக்கின் காரணமாக, சிறந்த எரிவாயு சட்டத்திற்குக் கீழ்ப்படியவில்லை. [7] சாலிட் ஃபார்மிக் அமிலம் (இரண்டு பாலிமோர்ப்ஸ்) ஹைட்ரஜன்-பக்கப்பட்ட ஃபார்மிக் அமில மூலக்கூறுகளை திறம்பட முடிவில்லாத நெட்வொர்க் கொண்டிருக்கிறது. இந்த ஒப்பீட்டளவில் சிக்கலான கலவை கூட நீர் (22.4%) மற்றும் திரவ வடிவ அமிலம் ஒரு super-boiling azeotrope உருவாக்குகிறது.
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 745. எண்ணிம ஆவணச் சுட்டி:10.1039/9781849733069-FP001. பன்னாட்டுத் தரப்புத்தக எண் 978-0-85404-182-4.
- ↑ 2.0 2.1 2.2 2.3 2.4 "NIOSH Pocket Guide to Chemical Hazards #0296". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Brown, H. C. et al., in Braude, E. A. and Nachod, F. C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- ↑ 4.0 4.1 "Formic acid". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health. 4 December 2014. பார்க்கப்பட்ட நாள் 26 March 2015.
- ↑ "Formic acid". McGill School of Computer Science. பார்க்கப்பட்ட நாள் 31 May 2022.
- ↑ "formic". etymonline. பார்க்கப்பட்ட நாள் 31 மே 2022.