மக்னீசியம் கார்பனேட்டு
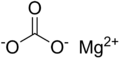
மக்னீசியம் கார்பனேட்டு(Magnesium carbonate) என்பது MgCO3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். மக்னீசியா ஆல்பா என்பது இச்சேர்மத்தின் பண்டைய பெயர் ஆகும். வெண்மை நிறத்தில் திண்ம நிலையில் இது காணப்படுகிறது. மக்னீசியம் கார்பனேட்டின் அடிப்படை கார்பனேட்டு வடிவங்களும் நீரேற்று வடிவங்களும் பல்வேறு கனிமங்களாகக் காணப்படுகின்றன.
| |

| |
| பெயர்கள் | |
|---|---|
| வேறு பெயர்கள்
மாக்னசைட்டு
பேரிங்டோனைட்டு (இருநீரேற்று) நெசுகியுவோனைட்டு (முந்நீரேற்று) லான்சுபோர்டைட்டு (ஐந்நீரேற்று) | |
| இனங்காட்டிகள் | |
| 546-93-0 (நீரிலி) 13717-00-5 (ஒருநீரேற்று) 5145-48-2 (இருநீரேற்று) 14457-83-1 (முந்நீரேற்று) 61042-72-6 (ஐந்நீரேற்று) | |
| ChEBI | CHEBI:31793 |
| ChEMBL | ChEMBL1200736 |
| ChemSpider | 10563 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 11029 |
| வே.ந.வி.ப எண் | OM2470000 |
| |
| பண்புகள் | |
| MgCO3 | |
| வாய்ப்பாட்டு எடை | 84.3139 கி/மோல் (நீரிலி) |
| தோற்றம் | வெண் திண்மம் நீருருஞ்சும் |
| மணம் | நெடியற்றது |
| அடர்த்தி | 2.958 கி/செ.மீ3 (நீரிலி) 2.825 கி/செ.மீ3 (இருநீரேற்று) 1.837 கி/செ.மீ3 (முந்நீரேற்று) 1.73 கி/செ.மீ3 (ஐந்நீரேற்று) |
| உருகுநிலை | 350 °C (662 °F; 623 K) சிதைவடையும் (நீரிலி) 165 °C (329 °F; 438 K) (முந்நீரேற்று) |
| நீரிலி: 0.0139 கி/100மி.லி (25 °செ) 0.00603 கி/100மி.லி (100 °செ)[1] | |
கரைதிறன் பெருக்கம் (Ksp)
|
10−7.8[2] |
| கரைதிறன் | அமிலத்தில் கரையும், நீரிய CO2 இல் கரையும் அசிட்டோன், அமோனியாவில் கரையாது. |
| −32.4•10−6 செ.மீ3/மோல் | |
| ஒளிவிலகல் சுட்டெண் (nD) | 1.717 (நீரிலி) 1.458 (இருநீரேற்று) 1.412 (முந்நீரேற்று) |
| கட்டமைப்பு | |
| படிக அமைப்பு | முக்கோணம் |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-1113 கியூ/மோல்[3] |
| நியம மோலார் எந்திரோப்பி S |
65.7 யூ/மோல்•K[1][3] |
| வெப்பக் கொண்மை, C | 75.6 யூ/மோல்•K[1] |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0969 |
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது |
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |
அனுமதிக்கத்தக்க வரம்பு
|
TWA 15 மி.கி/மீ3 (மொத்தம்) TWA 5 மி.கி/மீsup>3 (சுவாசம்)[4] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | மக்னீசியம் பைகார்பனேட்டு |
| ஏனைய நேர் மின்அயனிகள் | பெரிலியம் கார்பனேட்டு கால்சியம் கார்பனேட்டு இசுட்ரான்சியம் கார்பனேட்டு பேரியம் கார்பனேட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
வடிவங்கள்
தொகுமக்னீசியம் கார்பனேட்டின் பொதுவான வடிவம் மாக்னசைட்டு (MgCO3) எனப்படும் நீரிலி உப்பு வடிவமாகும். இருநீரேற்று, முந்நீரேற்று, ஐந்நீரேற்று வடிவ கார்பனேட்டு வடிவங்களும் காணப்படுகின்றன. இருநீரேற்று வடிவம் பேரிங்டோனைட்டு (MgCO3•2 H2O) என்றும் முந்நீரேற்று வடிவம் நெசுகியுவோனைட்டு (MgCO3•3 H2O) என்றும் ஐந்நீரேற்று வடிவம் லான்சுபோர்டைட்டு (MgCO3•5 H2O) என்றும் அழைக்கப்படுகின்றன[5]. ஆர்டினைட்டு (MgCO3•Mg(OH)2•3 H2O) , ஐதரோமாக்னசைட்டு (4 MgCO3•Mg(OH)2•4 H2O), டைபிங்கைட்டு 4 MgCO3• Mg(OH)2•5 H2O) போன்ற அடிப்படை கார்பனேட்டு வடிவங்களும் கனிமங்களாகக் காணப்படுகின்றன[5].
மாக்னசைட்டு சேர்மம் வெண்மை நிற முக்கோணப் படிகங்களால் ஆக்கப்பட்டுள்ளது. நீரிலியான இச்சேர்மம் நீர், அசிட்டோன், அமோனியா போன்ற கரைப்பான்களில் கரையாது. மக்னீசியம் கார்பனேட்டின் அனைத்து வடிவங்களும் அமிலத்துடன் வினைபுரியும். கால்சைட்டு கட்டமைப்பில் மக்னீசியம் கார்பனேட்டு படிகமாகிறது. இதில் Mg2+ அயனிகள் ஆறு ஆக்சிசன் அணுக்களால் சூழப்பட்டிருக்கும். இருநீரேற்று வடிவம் முச்சரிவு கட்டமைப்பில் படிகமாகிறது. முந்நீரேற்று வடிவம் ஒற்றைச் சரிவு படிக அமைப்பில் உள்ளது. இலேசான மற்றும் கனமான மக்னீசியம் கார்பனேட்டுகள் என்பவை பொதுவாக முறையே ஐதரோமாக்னசைட்டு, டைபிங்கைட்டு போன்ற ஐதரோமாக்னசைட்டுகளைக் குறிக்கின்றன[6].
தயாரிப்பு
தொகுமாக்னசைட்டு கனிமத்தை சுரங்கங்களிலிருந்து தோண்டி எடுப்பதன் மூலம் பொதுவாக மக்னீசியம் கார்பனேட்டு கிடைக்கிறது. கரையக்கூடிய ஏதாவதொரு மக்னீசியம் உப்பை சோடியம் பைகார்பனேட்டுடன் வினைபுரியச் செய்து ஆய்வகங்களில் மக்னீசியம் கார்பனேட்டு தயாரிக்கப்படுகிறது.:
MgCl2 (நீரிய) + 2NaHCO3 (நீரிய) → MgCO3 (திண்மம்) + 2NaCl (நீரிய) + H2O (நீர்மம்) + CO2 (வாயு)
ஒருவேளை மக்னீசியம் குளோரைடு அல்லது மக்னீசியம் சல்பேட்டு உப்பு நீரிய சோடியம் கார்பனேட்டுடன் சேர்க்கப்பட்டு சூடுபடுத்தப்பட்டால் அடிப்படை மக்னீசியம் கார்பனேட்டின் வீழ்படிவு , ஒரு மக்னீசியம் கார்பனேட்டு நீரேற்று அணைவு, மக்னீசியம் ஐதராக்சைடு போன்றவை உருவாகின்றன:
5MgCl2 (நீரிய) + 5Na2CO3 (நீரிய) + 5H2O (நீர்மம்) → Mg(OH)2•3MgCO3•3H2O (திண்மம்) + Mg(HCO3)2 (நீரிய) + 10NaCl(நீரிய)
அதிகத் தூய்மையுடன் தயாரிக்கப்படும் தொழிற்சாலை மக்னீசியம் கார்பனேட்டுகள் மக்னீசியம் பைகார்பனேட்டை உபயோகித்து தயாரிக்கப்படுகின்றன. மக்னீசியம் ஐதராக்சைடு, கார்பனீராக்சைடு கலந்த நீர்மக்குழம்பை உயர் அழுத்தம் மற்றும் மிதமான வெப்பத்தில் வினைபுரியச் செய்து இம்முறையில் மக்னீசியம் கார்பனேட்டு தயாரிக்கப்படுகிறது [5]. பைகார்பனேட்டு வெற்றிடத்தில் உலர்த்தப்பட்டு மக்னீசியம் கார்பனேட்டு பெறப்படுகிறது. கார்பனீராக்சைடும் நீர் மூலக்கூறும் வெளியேறுகின்றன.
Mg(OH)2 + 2 CO2 → Mg(HCO3)2 Mg(HCO3)2 → MgCO3 + CO2 + H2O
வினைகள்
தொகுஅமிலங்களுடன்
தொகுதொகுதி இரண்டில் உள்ள பல உலோகக் கார்பனேட்டுகள் போலவே மக்னீசியம் கார்பனேட்டும் நீர்த்த அமிலங்களுடன் வினைபுரிந்து கார்பனீராக்சைடையும் நீரையும் வெளிவிடுகின்றன.
- MgCO3 + 2 HCl → MgCl2 + CO2 + H2O
- MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
சிதைவு
தொகுஉயர் வெப்பநிலைகளில் MgCO3 சேர்மம் மக்னீசியம் ஆக்சைடாகவும் கார்பனீராக்சைடாகவும் சிதைவடைகிறது. மக்னீசியம் ஆக்சைடு தயாரிப்பில் இது ஒரு முக்கியமான செயல்முறையாகக் கருதப்படுகிறது[5]. கால்சினேற்றம் அல்லது நீற்றுதல் என்ற பெயரால் இதை அழைக்கிறார்கள்.
- MgCO3 → MgO + CO2 (ΔH = +118 கியூ/மோல்)
350 பாகை செல்சியசு வெப்பநிலை அல்லது 662 பாகை பாரன்கீட்டு இங்கு சிதைவு வெப்பநிலையாக வழங்கப்படுகிறது[7][8].
இருப்பினும், இந்த ஆக்சைடின் நீற்றுதல் பொதுவாக 900 பாகை செல்சியசு வெப்பநிலையிலும் முடியாது எனக் கருதப்படுகிறது. விடுவிக்கப்பட கார்பனீராக்சைடு மீண்டும் ஈர்க்கப்படுவது இதற்கான காரணமாகும்.
மேலும், சிதைவடையும் போது நீரேற்றுகள் வெவ்வேறு வெப்பநிலையில் நீர் மூலக்கூறுகளை இழக்கின்றன என்பது கவனிக்கத்தக்கதாகும்[9]. உதாரணமாக, Mg(HCO3)(OH)•2(H2O) என்ற மூலக்கூற்று வாய்ப்பாட்டில் எழுதப்படும் முந்நீரேற்றின் 157 பாகை செல்சியசு வெப்பநிலை மற்றும் 179 பாகை செல்சியசு வெப்பநிலைகளில் நீர்நீக்க சமன்பாடுகள் இங்கு தரப்படுகின்றன :[10]
- Mg(HCO3)(OH)•2(H2O) → Mg(HCO3)(OH)•(H2O) + H2O at 157 °C
- Mg(HCO3)(OH)•(H2O) → Mg(HCO3)(OH) + H2O at 179 °C.
பயன்கள்
தொகு- நீற்றுதல் அல்லது கால்சினேற்ற முறையில் மக்னீசியம் ஆக்சைடு தயாரிப்பது மக்னீசியம் கார்பனேட்டின் முக்கியமான பயனாகும்.
- மாக்னசைட்டும் டோலமைட்டும் அனல்தாங்கு தீச்செங்கற்கள் தயாரிப்பில் பயன்படுகின்றன[5].
- மேலும் தரையமைத்தல், தீயை அணைக்க உதவும் தீத்தடுப்புப் பொருட்களில் பகுதிப் பொருளாக, அழகுசாதனப் பொருட்கள், தூவும் தூள், மற்றும் பற்பசை ஆகியவற்றிலும் MgCO3 பயன்படுத்தப்படுகிறது.
- இவைதவிர நிரப்பும் பொருள், நெகிழிகளில் ஒடுக்கி, நியோபிரீன் ரப்பரில் வலுவூட்டும் முகவர், உலர்த்தும் முகவர், ஒரு மலமிளக்கி, மற்றும் உணவுகளை வண்ணமிழக்காமல் வைத்திருத்தல் போன்ற பல பயன்பாடுகளை மக்னீசியம் கார்பனேட்டு கொண்டுள்ளது.
- உயர் தூய்மை மக்னீசியம் கார்பனேட்டு அமிலமகற்றியாகவும், சமையல் உப்புடன் சேர்க்கப்படும் உணவுக்கூட்டு பொருளாகவும் பயன்படுத்தப்படுகிறது. கரைதிறன் குறைவு என்பதாலும் நீருருறிஞ்சும் தன்மையாலும் பாய்ச்சல் கருதி 1911 ஆம் ஆண்டு முதன்முதலாக சமையல் உப்புடன் மக்னீசியம் கார்பனேட்டு சேர்க்கப்பட்டது. மக்னீசியம் கார்பனேட்டு கலக்கப்பட்ட உப்பு ஈரச் சூழலுடன் ஒட்டாமல் பாய்ந்து விழும் [11]. *மலையேறுதல், எடை தூக்குதல் போன்ற விளையாட்டுகளில் பங்கேற்கும் விளையாட்டு வீரர்கள் தங்கள் உள்ளங்கைகளில் வழுக்காமல் இருக்கப் பயன்படுத்தும் தூளில் மக்னீசியம் கார்பனேட்டு பயன்படுத்தப்படுகிறது.
- உணவுக் கூட்டு பொருள்களில் இதைச் சேர்க்கிறார்கள். அதிக அடர்த்தியுடன் சேர்க்கப்பட்டால் இதுவொரு மளமிளக்கியாகச் செயல்படுகிறது என்பது மட்டுமே இதன் பக்க விளைவாகும் [12].
- தோற்பாவைக் கலையிலும் மக்னீசியம் கார்பனேட்டு வெளுக்கும் செயலுக்காகப் பயன்படுத்தப்படுகிறது. இதற்காக இதனுடன் ஐதரசன் பெராக்சைடை சேர்த்து பசையை உருவாக்குகிறார்கள்.
- திரையிடும் வெண் திரைகளில் பூச்சாக மக்னீசியம் கார்பனேட்டைப் பூசுகிறார்கள் [13].
பாதுகாப்பு
தொகுமக்னீசியம் கார்பனேட்டு நச்சுத்தன்மை வாய்ந்த ஒரு வேதிப்பொருள் அல்ல.
மேற்கோள்கள்
தொகு- ↑ 1.0 1.1 1.2 http://chemister.ru/Database/properties-en.php?dbid=1&id=634
- ↑ Bénézeth, Pascale; Saldi, Giuseppe D.; Dandurand, Jean-Louis; Schott, Jacques (2011). "Experimental determination of the solubility product of magnesite at 50 to 200 °C". Chemical Geology 286 (1–2): 21–31. doi:10.1016/j.chemgeo.2011.04.016.
- ↑ 3.0 3.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. பன்னாட்டுத் தரப்புத்தக எண் 0-618-94690-X.
- ↑ "NIOSH Pocket Guide to Chemical Hazards #0373". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 5.0 5.1 5.2 5.3 5.4 Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman (2005), "Magnesium Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, எண்ணிம ஆவணச் சுட்டி:10.1002/14356007.a15_595.pub2
- ↑ Botha, A.; Strydom, C.A. (2001). "Preparation of a magnesium hydroxy carbonate from magnesium hydroxide". Hydrometallurgy 62 (3): 175. doi:10.1016/S0304-386X(01)00197-9. https://archive.org/details/sim_hydrometallurgy_2001-11_62_3/page/175.
- ↑ "IAState MSDS". Archived from the original on 2016-04-25. பார்க்கப்பட்ட நாள் 2017-12-30.
- ↑ Weast, Robert C.; et al. (1978). CRC Handbook of Chemistry and Physics (59th ed.). West Palm Beach, FL: CRC Press. p. B-133. வார்ப்புரு:Listed Invalid ISBN.
- ↑ "Conventional and Controlled Rate Thermal analysis of nesquehonite Mg(HCO3)(OH)•2(H2O)" (PDF). Archived from the original (PDF) on 2014-11-02. பார்க்கப்பட்ட நாள் 2017-12-30.
- ↑ "Conventional and Controlled Rate Thermal analysis of nesquehonite Mg(HCO3)(OH)•2(H2O)" (PDF). Archived from the original (PDF) on 2014-11-02. பார்க்கப்பட்ட நாள் 2017-12-30.
- ↑ "Her Debut - Morton Salt". பார்க்கப்பட்ட நாள் 2017-12-27.
- ↑ "Food-Info.net : E-numbers : E504: Magnesium carbonates". 080419 food-info.net
- ↑ Noronha, Shonan (2015). Certified Technology Specialist-Installation. McGraw Hill Education. p. 256. பன்னாட்டுத் தரப்புத்தக எண் 978-0071835657.