பிசுமத் குளோரைடு
பிசுமத் குளோரைடு (Bismuth chloride) என்பது BiCl3 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். பிசுமத் வெண்ணெய் என்ற பெயராலும் இச்சேர்மம் அறியப்படுகிறது. ஒரு சகப்பிணைப்புச் சேர்மமான இது Bi3+ அயனியை வழங்கும் ஒரு பொது மூலமாகக் கருதப்படுகிறது. வாயு கட்டத்திலும், படிகத்திலும், இணைதிறன் கூடு எலக்ட்ரான் சோடி தள்ளுகைக் கோட்பாட்டின்படி, இந்த இனங்கள் ஒரு பிரமிடு அமைப்பைப் பின்பற்றுகின்றன.
| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
பிசுமத் குளோரைடு
| |
| வேறு பெயர்கள்
பிசுமத் முக்குளோரைடு, முக்குளோரோபிசுமத்து, முக்குளோரோபிசுமத்தின், பிசுமத்(III) குளோரைடு
| |
| இனங்காட்டிகள் | |
| 7787-60-2 | |
| ChemSpider | 22993 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 24591 |
| வே.ந.வி.ப எண் | EB2690000 |
| |
| UNII | 4X6566U3SD |
| பண்புகள் | |
| BiCl3 | |
| வாய்ப்பாட்டு எடை | 315.34 கி/மோல் |
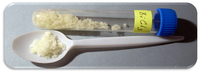
| தோற்றம் | நீர் உறிஞ்சும் திறன் மஞ்சள் முதல் வெண்மை நிறப் படிகங்கள் |
| அடர்த்தி | 4.75 கி/செ.மீ3 |
| உருகுநிலை | 227 °C (441 °F; 500 K) |
| கொதிநிலை | 447 °C (837 °F; 720 K) |
| கரையும், நீராற்பகுப்புக்கு உட்படும் | |
| கரைதிறன் | மெத்தனால், டை எத்தில் ஈதர், அசிட்டோன் கரைப்பான்களில் கரையும் |
| -26.5·10−6 செ.மீ3/மோல் | |
| கட்டமைப்பு | |
| படிக அமைப்பு | கனசதுரம் |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-1.202 கிலோயூல்/கிராம் |
| நியம மோலார் எந்திரோப்பி S |
82.9 யூல்/(கெல்வின் மோல்) |
| வெப்பக் கொண்மை, C | 0.333 யூல்/(கிராம் கெல்வின்) |
| தீங்குகள் | |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | JT Baker |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
3324 மி.கி/கி.கி, வாய்வழி (எலி) |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | பிசுமத் புளோரைடு, பிஸ்மத் சப்சாலிசிலேட், பிசுமத் மூவாக்சைடு |
| ஏனைய நேர் மின்அயனிகள் | இரும்பு(III) குளோரைடு, மாங்கனீசு(II) குளோரைடு, கோபால்ட்(II) குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தயாரிப்பு
தொகுகுளோரின் வாயுவை பிசுமத்தின் மீது நேரடியாகச் செலுத்தி வினைபுரியச் செய்வதன் மூலம் பிசுமத் குளோரைடைத் தயாரிக்கலாம்.
- 2 Bi + 3 Cl2 → 2 BiCl3
அல்லது பிசுமத் உலோகத்தை இராச திராவத்தில் கரைத்து ஆவியாக்கினால் பிசுமத் குளோரைடு இருநீரேற்று (BiCl3·2H2O) உருவாகும். இதை வாலை வடித்தலுக்கு உட்படுத்தி நீரற்ற பிசுமத் குளோரைடு தயாரிக்கலாம்.[1]
மாற்றாக, பிசுமத் ஆக்சைடுடன் ஐதரோகுளோரிக் அமிலத்தைச் சேர்த்து கரைசலை ஆவியாக்குவதன் மூலமும் பிசுமத் குளோரைடு தயாரிக்கப்படுகிறது.
- Bi2O3 + 6 HCl → 2 BiCl3 + 3 H2O
பிசுமத்தை அடர் நைட்ரிக் அமிலத்தில் கரைத்து பின்னர் கரைசலுடன் சோடியம் குளோரைடைச் சேர்த்து வினைபுரியச் செய்வதன் மூலமும் இதைத் தயாரிக்கலாம்.[2]
- Bi + 6 HNO3 → Bi(NO3)3 + 3 H2O + 3 NO2
- Bi(NO3)3 + 3 NaCl → BiCl3 + 3 NaNO3
கட்டமைப்பு
தொகுவாயு கட்டத்தில் பிசுமத் குளோரைடு பிரமிடு வடிவில் Cl–Bi–Cl கோணம் 97.5° மற்றும் பிணைப்பு நீளம் 242 பைக்கோமீட்டர் என்ற அளவுகளுடன் உள்ளது.[3] திண்ம நிலையில், ஒவ்வொரு பிசுமத்து அணுவும் 250 பைக்கோமீட்டர் தொலைவில் மூன்று அண்டை அணுக்களைக் கொண்டுள்ளன. இவற்றில் இரண்டு 324 பைக்கோமீட்டர் தொலைவிலும் மூன்றின் சராசரியாக 336 பைக்கோமீட்டர் தொலைவிலும் உள்ளன.[4] மேலே உள்ள படம் மூன்று நெருங்கிய அண்டை அணுக்களை முன்னிலைப்படுத்துகிறது. இந்த அமைப்பு AsCl3, AsBr3, SbCl3 மற்றும் SbBr3 சேர்மங்களைப் போன்றதாகும்.
வேதிப் பண்புகள்
தொகுபிசுமத் குளோரைடு எளிதாக நீராற்பகுத்தலுக்கு உட்பட்டு பிசுமத் ஆக்சிகுளோரைடைக் (BiOCl) கொடுக்கிறது:[5]
- Bi3+ (நீரிய) + Cl- (நீரிய) + H2O(நீர்மம்) ⇌ BiOCl (திண்மம்) + 2 H+(நீரிய)
ஐதரோகுளோரிக் அமிலம் போன்ற ஓர் அமிலத்தைச் சேர்த்தால் இவ்வினை மீட்சியடைகிறது[6]
50 °செல்சியசுக்கும் குறைவான வெப்பநிலையில் நீராவியுடன் திண்ம BiCl3 வினைபுரிந்து BiCl3·H2O என்ற வாய்பாட்டைக் கொண்ட இடைநிலை ஒற்றைநீரேற்றை உருவாக்குகிறது.[7]
பிசுமத் குளோரைடு ஒரு ஆக்சிசனேற்ற முகவராகும். எனவே ஒடுக்கும் முகவர்களை பயன்படுத்தி இச்சேர்மத்தை உலோக பிசுமத்தாக குறைக்க இயலும்.
குளோரோ அணைவுச் சேர்மங்கள்
தொகுவழக்கமான எதிர்பார்ப்புகளுக்கு மாறாக, குறிப்பிட்ட தனிமவரிசை அட்டவணைப் போக்குகளுக்கு ஒத்துப்போகும் வகையில், BiCl3 என்பது ஓர் இலூயிசு அமிலமாகும். இது [BiCl6]3− போன்ற பல்வேறு குளோரோ அணைவுச் சேர்மங்களை இது உருவாக்குகிறது. எண்ம விதியை கடுமையாக மீறுகிறது. மேலும், இந்த ஒருங்கிணைப்பு அணைவின் எண்முக அமைப்பு இணைதிறன் கூடு எலக்ட்ரான் சோடி தள்ளுகைக் கோட்பாட்டின் கணிப்புகளைப் பின்பற்றவில்லை. ஏனெனில் பிசுமத்தில் உள்ள தனி சோடி எலக்ட்ரான் எதிர்பாராத விதமாக முப்பரிமான நிலையில் செயலற்றதாக உள்ளது. ஈரெதிர்மின் அயனி அணைவான [BiCl5]2− எதிர்பார்க்கப்படும் சதுர பிரமிடு அமைப்பை ஏற்றுக்கொள்கிறது.[8]
| Cs3[BiCl6] | Cs3[BiCl6] | [BiCl6]3− |
கரிம வினையூக்கி
தொகுபிசுமத் குளோரைடு கரிமத் தொகுப்பு வினைகளில் வினையூக்கியாகப் பயன்படுத்தப்படுகிறது. குறிப்பாக, இது மைக்கேல் வினை மற்றும் முகையாமா ஆல்டால் வினை ஆகியவற்றை ஊக்குவிக்கிறது. மற்ற உலோக அயோடைடுகளைச் சேர்ப்பதால் இதன் வினையூக்கச் செயல்பாடு அதிகரிக்கிறது.[9]
மேற்கோள்கள்
தொகு- ↑ Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. (1998). Nicholas C. Norman (ed.). Chemistry of arsenic, antimony, and bismuth. Springer. p. 90. பன்னாட்டுத் தரப்புத்தக எண் 0-7514-0389-X.
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, பன்னாட்டுத் தரப்புத்தக எண் 0-07-049439-8
- ↑ Töke, Orsolya, and Magdolna Hargittai. "Molecular structure of bismuth trichloride from combined electron diffraction and vibrational spectroscopic study." Structural Chemistry 6.2 (1995): 127–130.
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition, pp. 879–884, Oxford Science Publications, பன்னாட்டுத் தரப்புத்தக எண் 0-19-855370-6
- ↑ Joel Henry Hildebrand (2008). Principles of Chemistry. BiblioBazaar, LLC. p. 191. பன்னாட்டுத் தரப்புத்தக எண் 978-0-559-31877-1.
- ↑ Frank Welcher (2008). Chemical Solutions. READ BOOKS. p. 48. பன்னாட்டுத் தரப்புத்தக எண் 978-1-4437-2907-9.
- ↑ Wosylus, Aron; Hoffmann, Stefan; Schmidt, Marcus; Ruck, Michael (2010). "In-situ Study of the Solid-Gas Reaction of BiCl3 to BiOCl via the Intermediate Hydrate BiCl3·H2O". European Journal of Inorganic Chemistry 2010 (10): 1469–1471. doi:10.1002/ejic.201000032. பன்னாட்டுத் தர தொடர் எண்:1434-1948.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5.
- ↑ Hitomi Suzuki; Yoshihiro Matano (2001). Organobismuth chemistry. Elsevier. pp. 403–404. பன்னாட்டுத் தரப்புத்தக எண் 0-444-20528-4.