அல்லைல் குளோரைடு
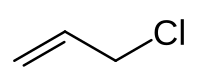
அல்லைல் குளோரைடு (Allyl chloride) என்பது CH2=CHCH2Cl என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கரிம வேதியியல் சேர்மமாகும். இந்த நிறமற்ற நீர்மம் தண்ணீரில் கரையாது ஆனால் பொதுவான கரிம கரைப்பான்களில் கரையும். நெகிழிகள் உற்பத்திக்குப் பயன்படும் எபிகுளோரோவைதரின் தயாரிப்புக்கு இச்சேர்மம் பெரும்பாலும் பயன்படுகிறது. ஆல்கைலேற்றும் முகவரான அல்லைல் குளோரைடு புரோப்பலீனின் குளோரினேற்ற வழிப்பெறுதி என்று வகைப்படுத்தப்படுகிறது.[4]
| |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர்
3-குளோரோபுரோப்-1-யீன் | |||
| வேறு பெயர்கள் | |||
| இனங்காட்டிகள் | |||
| 107-05-1 | |||
| ChEBI | CHEBI:82379 | ||
| ChEMBL | ChEMBL451126 | ||
| ChemSpider | 13836674 | ||
| EC number | 209-675-8 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| KEGG | C19316 | ||
| பப்கெம் | 7850 | ||
| வே.ந.வி.ப எண் | UC7350000 | ||
| |||
| UNII | V2RFT0R50S | ||
| UN number | 1100 | ||
| பண்புகள் | |||
| C3H5Cl | |||
| வாய்ப்பாட்டு எடை | 76.52 g·mol−1 | ||
| தோற்றம் | நிறமற்றது, பழுப்பு, மஞ்சள் நீர்மம்[1] | ||
| மணம் | காரச்சுவை, விரும்பத்தகாத சுவை[1] | ||
| அடர்த்தி | 0.94 கி/மி.லி | ||
| உருகுநிலை | −135 °C (−211 °F; 138 K) | ||
| கொதிநிலை | 45 °C (113 °F; 318 K) | ||
| 0.36 கி/100 மி.லி (20 °செல்சியசு) | |||
| கரைதிறன் | ஈதர், அசிட்டோன், பென்சீன், குளோரோபாரம் போன்றவற்றில் கரையும் | ||
| ஆவியமுக்கம் | 295 மி.மீ.பாதரசம்[1] | ||
| ஒளிவிலகல் சுட்டெண் (nD) | 1.4055 | ||
| பிசுக்குமை | 0.3130 மெகாபாசுக்கல்.வி[2] | ||
| தீங்குகள் | |||
| GHS pictograms |    
| ||
| GHS signal word | அபாயம் | ||
| H225, H302, H312, H315, H319, H332, H335, H341, H351, H373, H400 | |||
| P201, P202, P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P273 | |||
| தீப்பற்றும் வெப்பநிலை | −32 °C (−26 °F; 241 K) | ||
Autoignition
temperature |
390 °C (734 °F; 663 K) | ||
| வெடிபொருள் வரம்புகள் | 2.9–11.2% | ||
| Lethal dose or concentration (LD, LC): | |||
LC50 (Median concentration)
|
11000 மி.கி/மீ3 (எலி, 2 மணி) 11500 மி.கி/மீ3 (சுண்டெலி, 2 மணி) 5800 மி.கி/மீ3 (கினி பன்றி, 2 மணி) 22500 மி.கி/மீ3 (முயல், 2 மணி) 10500 மி.கி/மீ3 (பூனை, 2 மணி)[3] | ||
| அமெரிக்க சுகாதார ஏற்பு வரம்புகள்: | |||
அனுமதிக்கத்தக்க வரம்பு
|
மொத்த எடை சராசரி மில்லியனுக்கு 1 பகுதி (3 மி.கி/மீ3)[1] | ||
பரிந்துரைக்கப்பட்ட வரம்பு
|
மொத்த எடை சராசரி மில்லியனுக்கு 1 பகுதி (3 மி.கி/மீ3) எசு.டி மில்லியனுக்கு 2 பகுதிகள் (6 மி.கி/மீ3)[1] | ||
உடனடி அபாயம்
|
மில்லியனுக்கு 250 பகுதிகள்[1] | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
தயாரிப்பு
தொகுஆய்வக அளவு
தொகுஅல்லைல் ஆல்ககாலுடன் பாசுபரசு முக்குளோரைடைச் சேர்த்து முதன்முதலில் 1857 ஆம் ஆண்டு அல்லைல் குளோரைடு தயாரிக்கப்பட்டது. அகசுட்டி கேகார்சும் ஆகசுட்டு ஆப்மானும் இத்தயாரிப்பை நிகழ்த்தினர்.[5][4] நவீன தயாரிப்பு நெறிமுறைகள் இந்த அணுகுமுறையை சிக்கனமாக்குகின்றன. ஒப்பீட்டளவில் விலையுயர்ந்த பாசுபரசு முக்குளோரைடிற்குப் பதிலாக ஐதரோகுளோரிக் அமிலத்துடன் தாமிரம்(I) குளோரைடு போன்ற வினையூக்கி வினையில் பயன்படுத்தப்படுகிறது[6].
தொழிற்சாலை அளவு
தொகுபுரோப்பைலீனை குளோரினேற்றம் செய்து பெருமளவில் அல்லைல் குளோரைடு தயாரிக்கப்படுகிறது. தாழ் வெப்பநிலைகளில் 1,2-இருகுளோரோபுரோப்பேன் உருவாகும். ஆனால் 500 பாகை செல்சியசு வெப்பநிலையில் அல்லைல் குளோரைடு உருவாகிறது.
- CH3CH=CH2 + Cl2 → ClCH2CH=CH2 + HCl
1997 ஆம் ஆண்டில் இந்த வழிமுறையில் 800,000 டன்கள் அல்லைல் குளோரைடு உற்பத்தி செய்யப்பட்டதாக மதிப்பிடப்பட்டுள்ளது.[4]
வினைகளும் பயன்களும்
தொகுஅல்லைல் குளோரைடின் பெரும்பகுதி எபிகுளோரோ ஐதரினாக மாற்றப்படுகிறது.[4] அல்லைல் ஆல்ககால், அல்லைலமீன், அல்லைல் ஐசோதயோசயனேட்டு[7] மற்றும் 1-புரோமோ-3-குளோரோபுரோப்பேன் ஆகியவை வணிகரீதியான குறிப்பிடத்தக்க பிற வழித்தோன்றல்களில் அடங்கும்.
அல்கைலேற்றும் முகவராக, கடுகு எண்ணெய் போன்ற மருந்துகள் மற்றும் பூச்சிக்கொல்லிகள் தயாரிப்பதில் அல்லைல் குளோரைடு பயனுள்ளதாக இருக்கும்.
விளக்க வினைகள்
தொகுஅல்லைல் குளோரைடின் வினைத்திறனை விளக்குவது அல்லைல் சயனைடுக்கான (CH2=CHCH2CN) இதன் சயனேற்ற வினையாகும்.[8] அல்கைல் ஆலைடு வினைத்திறன் வாய்ந்தது என்பதால், இது ஈரல்லைலைக் கொடுக்க குறைக்கும் இணைப்பிற்கு உட்படுகிறது:[9]
- 2 ClCH2CH=CH2 + Mg → (CH2)2(CH=CH2)2 + MgCl2
பல்லேடியம்(0) உடன் ஆக்சிசனேற்ற கூட்டாக வினைபுரிந்து அல்லைல்பலேடியம் குளோரைடு இருபடியைக் (C3H5)2Pd2Cl2 கொடுக்கிறது. ஐதரசன் ஆலைடு நீக்க வினையில் வளையபுரோப்பீனை அளிக்கிறது.
பாதுகாப்பு
தொகுஅல்லைல் குளோரைடு மிகவும் நச்சுத்தன்மையுடையது மற்றும் எரியக்கூடியது. கண் பாதிப்புகள் தாமதமாகி பார்வைக் குறைபாட்டிற்கு வழிவகுக்கும்.[10]
மேலும் பார்க்க
தொகுமேற்கோள்கள்
தொகு- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 "NIOSH Pocket Guide to Chemical Hazards #0018". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Viswanath, D.S.; Natarajan, G. (1989). Data Book on the Viscosity of Liquids. Hemisphere Publishing Corporation. பன்னாட்டுத் தரப்புத்தக எண் 0-89116-778-1.
- ↑ "Allyl chloride". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 4.0 4.1 4.2 4.3 Ludger Krähling, Jürgen Krey, Gerald Jakobson, Johann Grolig, Leopold Miksche “Allyl Compounds” in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005. Published online: 15 June 2000.
- ↑ Hofmann. Augustus William and Cahours. Augustus (1857) "Researches on a new class of alcohols," Philosophical Transactions of the Royal Society of London, 147: 555–574 ; see pp. 558–559.
- ↑ Furniss, Brian; Hannaford, Antony; Smith, Peter; Tatchell, Austin (1996). Vogel's Textbook of Practical Organic Chemistry (5th ed.). London: Longman Science & Technical. pp. 558. பன்னாட்டுத் தரப்புத்தக எண் 9780582462366.
- ↑ F. Romanowski, H. Klenk "Thiocyanates and Isothiocyanates, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH: Weinheim. எஆசு:10.1002/14356007.a26_749
- ↑ J. V. Supniewski; P. L. Salzberg (1941). "Allyl Cyanide". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=CV1P0046.; Collective Volume, vol. 1, p. 46
- ↑ Amos Turk; Henry Chanan (1947). "Biallyl". Org. Synth. 27: 7. doi:10.15227/orgsyn.027.0007.
- ↑ International Programme on Chemical Safety & the Commission of the European Communities. "Allyl Chloride". International Chemical Safety Cards. © IPCS CEC 1993. Archived from the original on 2016-03-04. பார்க்கப்பட்ட நாள் 13 February 2012.
புற இணைப்புகள்
தொகு- International Chemical Safety Card 0010
- "NIOSH Pocket Guide to Chemical Hazards #0018". National Institute for Occupational Safety and Health (NIOSH).
- IARC Monograph *Allyl chloride.

